Introducción
En nuestro país, la tasa de natalidad es de aproximadamente 250.000 nacimientos al año y el 2,9% de ellos corresponden a pacientes con Síndrome de Down (SD). Los virus respiratorios son los responsables de más del 60% de las infecciones respiratorias agudas bajas (IRAB) en la población pediátrica6.
Se han identificado varios grupos de virus responsables de las hospitalizaciones en lactantes y niños: virus respiratorio sincicial (VRS), adenovirus, parainfluenza, influenza y metapneumovirus humano, siendo el VRS la causa principal18.
Durante los dos primeros años de vida cerca de un 95% de los niños han cursado con infección por VRS, y aproximadamente un 2% de los lactantes requiere hospitalización; la epidemia se extiende entre mayo y septiembre en nuestro medio. El nacimiento prematuro y la enfermedad cardíaca congénita se conocen como factores de riesgo para enfermedades graves por VRS. El síndrome de Down se asocia a un alto riesgo de enfermedades del tracto respiratorio, poco se conoce sobre la incidencia y hospitalización por VRS en niños con SD, información que es relevante dado la existencia de anticuerpos monoclonales específicos -palivizumab-8, hoy disponibles en Chile para los prematuros extremos. Estudios demuestran que el tener SD ya es un riesgo para enfermedades del tracto respiratorio, Por sus características físicas, alteraciones morfológicas de las vías respiratorias superiores e inferiores, alteraciones inmunológicas, hipertensión pulmonar, e hipotonía muscular, los niños con SD tienen una elevada incidencia de IRAB que requieren hospitalización, incluyendo bronquiolitis por VRS e incluso sibilancias recurrentes5. El estudio CIVIC 21 realizado en España entre el año 2006 y 200827,28 pone de manifiesto que los menores de dos años con SD y cardiopatía congénita no significativa es el grupo con más riesgo de ingreso en el hospital por IRAB por VRS, En Canadá se compararon 233 niños con SD con y sin profilaxis con palivizumab, observándose 3.63 veces más probabilidades de hospitalización por VRS que los niños que recibieron palivizumab24. En nuestro medio no existen datos sobre la frecuencia hospitalizaciones por VRS en niños con SD, información que podría ser de utilidad en una eventual ampliación del plan de administración de anticuerpos monoclonales a nivel nacional. El objetivo de nuestro estudio fue conocer la frecuencia de hospitalización por VRS, en niños menores de dos años con Síndrome de Down atendidos en el hospital Roberto del Río.
Materiales y Métodos
Se revisó la base de datos de niños con SD atendidos en el policlínico de genética y las historias clínicas de los niños hospitalizados por IRAB durante los años 2014-2015 en el Hospital Roberto del Río. Se contó con la autorización del Comité de Ética de la Investigación del Servicio de Salud Metropolitano Norte.
Se hizo un análisis descriptivo de variables tales como edad, sexo y se correlacionaron estas variables con el tiempo de hospitalización, condición clínica de los pacientes e infección por VRS. Para ello se utilizó Programa SPSS (Statistical Package for the Social Sciences/Programa estadístico para las Ciencias Sociales).
Resultados
En los años 2014-2015 fueron atendidos un total de 60 niños con SD en el hospital Roberto del Río, de los cuales 24 fueron hospitalizados con IRAB, que corresponde a un 40% del universo estudiado.
Al analizar los niños hospitalizados, el 70,8% son de sexo femenino, 33% menores de 1 año y con edad mínima de 4 meses. Un 41,7% presentó VRS +. La mayoría de los casos menores de 1 año fue VRS negativo.
Cabe destacar que el promedio de hospitalización fue entre 7-10 días aproximadamente.
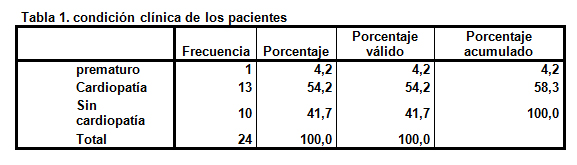
Al comparar los resultados de hospitalización de los niños con SD y cardiopatía congénita asociada se observa que en un 54,2% se asoció con IRAB (tabla 1).
Discusión
A partir de estos resultados se puede observar que los niños con SD y cardiopatía asociada atendidos en el hospital Roberto del Rio presentan hospitalización frecuente por infección respiratoria aguda, siendo parte de la población predispuesta a infección grave por VRS1. Sin embargo la presencia de VRS positivo se muestra en menor porcentaje con respecto a la cantidad de pacientes con infección respiratoria aguda, lo que podría estar determinado por la sensibilidad y especificidad de las muestras de inmunofluorescencia que está siendo usada a nivel público. Esto podría mejorar e incluir nuevas tecnologías para la detección del virus como PCR (Reacción de Cadena de Polimerasa), especialmente importante en pacientes de mayor gravedad.
La hospitalización en niños con SD se encuentra mayormente asociado a aquellos portadores de cardiopatía congénita, lo que coincide con lo descrito en la literatura de un 40-50%29.
En base a literatura internacional revisada para este trabajo se podría tomar en cuenta el uso de Palivizumab para disminuir la tendencia de hospitalización y gravedad en los niños con síndrome de Down y cardiopatía asociada15,16, así como también se verían beneficiados los prematuros entre las 33 y 35 semanas24.
Actualmente existe suficiente evidencia para afirmar que el VRS es uno de los principales virus causantes de IRAB en lactantes hasta los 2 años, y que los niños SD con cardiopatía asociada se hospitalizan con más frecuencia en relación con la población general, confirmado con este estudio.
Aunque el uso de Palivizumab Profiláctico ha mostrado ser efectivo para disminuir los días de hospitalización y gravedad de IRAB asociada a VRS, el costo que representa lo vuelve inaccesible en estos momentos a nuestros usuarios, por lo que sería clave crear políticas de salud que puedan incluir a nuestros niños SD y evaluar el costo beneficio que representa creando programas pilotos que se puedan extender luego a nivel nacional, todo esto asociado a otras políticas públicas que incluya.
Disminuir en estos pacientes las dificultades de acceso a atención medica en los servicios públicos, los tiempos prolongados de espera en los servicios de urgencia y enfatizar en ellos las políticas de salud preventiva.
Las limitaciones de este estudio no permiten evaluar realmente la frecuencia de hospitalización por VRS en menores de 1 año en toda la población de niños con SD, con y sin cardiopatía, idealmente con información a nivel nacional. Este dato sería importante si en algún momento se pretende ampliar la cobertura de profilaxis con palivizumab en la población de niños con SD menores de 1 año.
Referencias
- Figueras J., López J., Medrano C., Bermúdez-Cañete R., Fernández L., Bonillo P.A., et-al. Consenso multidisciplinar español sobre la profilaxis de la infección respiratoria pediátrica por virus respiratorio sincitial. An Pediatr (Barc). 2008; 69:63-71.
- Beers M.H. Explicit criteria for determining potentially inappropriate medication use by the elderly. Arch Intern Med. 1997; 157:1531-6.
- American Academy of Pediatrics Subcommittee on Diagnosis and Management of Bronchiolitis.Diagnosis and management of bronchiolitis. Pediatrics.2006; 118:1774-93.
- Behrendt C.E., Decker M.K., Burch D.J., Watson P.H., International RSV Study Group. International variation in the management of infants hospitalized with respiratory syncytial virus. Eur J Pediatr. 1998; 157:215-20.
- Bloemeres B.L.P., Van Furth A.M., Weijerman M.E., Gemke R.J.B., Broers C.J.M., Van den Ende K., et-al. Down syndrome: A novel risk factor for respiratory syncytial virus bronchiolitis. A prospective birth-cohortstudy. Pediatrics. 2007; 120:1076-81.
- Bonillo Perales A., Díez-Delgado Rubio J., Ortega Montes A., Infante Márquez P., Jiménez Liria M.R., Batlles Garrido J., et-al, Comparación con el Impact-RSV StudyGroup. Antecedentes perinatales y hospitalización por bronquiolitis. An EspPediatr. 2000; 53:527-32.
- Boyce T.G., Mellen B.G., Mitchel E.F., Wright P.F., Griffin M.R. Rates of hospitalization for respiratory syncytial virus infection among children in Medicaid. J Pediatr. 2000; 137:865-70.
- Bustos Lozano G, De la Cruz Bértolo J, Farfán Sedano FJ. Recomendaciones de inmunoprofilaxis del virus respiratorio sincitial con palivizumab. Efectividad de Medicamentos en Neonatología. Madrid: Dirección General de Farmacia y Productos Sanitarios (Consejería de Sanidad y Consumo. Comunidad de Madrid); 2004.
- Carbonell-Estrany X., Quero J., IRIS StudyGroup. Hospitalization rates for respiratory syncytial virus infection in premature infants born during two consecutive seasons. Pediatr Infect Dis J. 2001; 20:874-9.
- Chávez-Bueno S., Mejías A., Welliver R.C. Respiratory syncytial virus bronchiolitis. Current and future strategies for treatment and prophylaxis. Treat Respir Med. 2006; 5:483-94.
- Chiroli S., Macagno F., Lucioni C. Cost-efficacy analysis of palivizumab in the prevention of respiratory syncytial virus infections in young children with hemodynamically significant congenital heart disease. Ital J Pediatr.2005; 31:188-94.
- Christakis DA, Cowan CA, Garrison MM, Molteni R, Marcase E, Zerr DM. Variation in inpatient diagnostic testing and management of bronchiolitis. Pediatrics. 115:878–3.
- Cilla G., Sarasua A., Montes M., Arostegui N., Vicente D., Pérez-Yarza E., et-al. Risk factors for hospitalization due to respiratory syncytial virus infection among infants in the Basque Country, Spain.Epidemiol Infect. 2006; 134:506-13.
- Cohen S.A., Zanni R., Cohen A., Harrington M., Vanveldhuisen P., Boron M.L., for the Palivizumab Outcomes Registry Group. Palivizumab use in subjects with congenital heart disease: Results from the 2000–2004 palivizumab outcomes registry. PediatrCardiol. 2008; 29:382-7.
- Duppenthaler A., Ammann R.A., Gorgievski-Hrisoho M., Pfammatter J.P., Aebi C. Low Incidence of respiratory syncytial virus hospitalisations in haemodynamically significant congenital heart disease. Arch Dis Child.2004; 89:961-5.
- Feltes T.F., Cabalka A.K., Meissner H.C., Piazza F.M., Carlin D.A., Top F.H., et-al, for the Cardiac Synagis Study Group. Palivizumab prophylaxis reduces hospitalization due to respiratory syncytial virus in young children with hemodynamicallysignificat congenital heart disease. J Pediatr. 2003; 143:532-40.
- Figueras Aloy J., Carbonell-Estrany X., Quero J., para el Iris StudyGroup. Estudio de casos y controles de los factores de riesgo relacionados con la infección por el virus respiratorio sincitial que precisa hospitalización en niños prematuros de 33–35 semanas de edad gestacional en España. PediatrInfectDis J. 2004; 23:815-20.
- Figueras Aloy J., Quero J., el Comité de Estándares de la Sociedad Española de Neonatología. Recomendaciones para la prevención de la infección por virus respiratorio sincitial. AnPediatr (Barc). 2005; 63:357-62.
- Grimaldi M., Gouyon B., Michaut F., Huet F., Gouyon J.B. Burgundy Perinatal Network. Severe respiratory syncytial virus bronchiolitis: Epidemiologic variations associated with the initiation of palivizumab in severely premature infants with bronchopulmonary dysplasia. Pediatr Infect Dis J. 2004; 23:1081-5.
- Henckel E., Luthander J., Berggren E., Kapadia H., Naver L., Norman M., et-al. Palivizumabpropylaxis and hospitalization for respiratory syncytial virus disease in the Stockholm infant population. Pediatr Infect Dis J. 2004; 23:27-31.
- Joffe S., Ray G.T., Escobar G.J., Black S.B., Lieu T.A. Cost-effectiveness of respiratory syncytial virus prophylaxis among preterm infants. Pediatrics.1999; 104:419-27.
- Lacaze-Masmonteil T., Rozé J.C., Fauroux B. French Pediatricians’ Group of Sunagis Patients’ Name-Based Programs. Incidence of respiratory syncytial virus related hospitalizations in high-risk children. PediatrPulmonol. 2002; 34:181-8.
- Lacaze-Masmonteil T., Truffert P., Pinquier D., Daoud P., Goldfarb G., Vicaut E., et-al. Lower respiratory tract illness and RSV prophylaxis in veri premature infants. Arch Dis Child.2004; 89:562-7.
- Law B.J., Langley J.M., Allen U., Paes B., Lee D.S.C., Ian Mitchell , et-al. The Pediatric Investigators Collaborative Network on Infections in Canada Study of predictors of hospitalization for respiratory syncitial virus. PediatrInfectDis. 2004; 23:806-14.
- Lázaro y de Mercado P., Figueras Aloy J., Doménech Martínez E., Echániz Urcelay I., ClosaMonasterolo R., Wood Wood M.A., et-al. La eficiencia (coste-efectividad) de palivizumab como profilaxis para la infección por virus respiratorio sincitial en prematuros de 32–35 semanas en España. AnPediatr (Barc). 2006; 65:316-24.
- Medrano C., García-Guereta L., Grueso J., Insa B., Ballesteros F., Casaldaliga J., et-al, CIVIC Study Group from the Spanish Society of Pediatric Cardiology and Congenital Heart Disease. Respiratory infection in congenital cardiac disease. Hospitalizations in young children in Spain during 2004 and 2005: The CIVIC Epidemiologic Study. Cardiol Young. 2007; 17:360-71.
- Medrano López C., García-Guereta Silva L. Infecciones respiratorias y cardiopatías congénitas: dos estaciones del estudio CIVIC. AnPediatr (Barc). 2007; 67:329-36.
- Medrano López C., García-Guereta Silva L., Lirio Casero J., García Pérez J., en representación del Grupo CIVIC, Grupo de Trabajo de Infecciones de la Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas. Infecciones respiratorias, Síndrome de Down y cardiopatías congénitas: estudio CIVIC 21. AnPediatr (Barc). 2009; 71:38-46.
- Nakazawa M., Saji T., Ichida F., Oyama K., Harada K., Kususda S. Guidelines for the use of palivizumab in infants and young children with congenital heart disease. Pediatr Int. 2006; 48:190-3.
- Nuijten M.J.C., Wittenberg W., Lemeier M. Cost effectiveness of pavilizumab for respiratory syncytial virus prophylaxis in high-risk children. Pharmacoeconomics.2007; 25:55-71.
- Wegner S., Vann J.J., Liu G., Byrns P., Cypra C., Campbell W., et-al. Direct cost analyses of palivizumab treatment in a cohort of at-risk children: Evidence from the North Carolina Medicaid Program. Pediatrics. 2004; 114:1612-9.
|

