Introducción
En el contexto de la prematuridad, un aspecto importante es el grado de desarrollo del pulmón.
La inmadurez de este órgano es una de las primeras causas de morbimortalidad perinatal de los niños nacidos antes de término.
El grado de madurez fetal está íntimamente relacionado con la capacidad tensoactiva del surfactante.
La administración exógena de surfactante desde el año 1990 y el amplio uso de corticoides prenatales desde 1994 en adelante, han sido claves en la disminución de la morbimortalidad de los prematuros en el mundo. (1,2)
Significado fisiológico
Mediante el estudio del surfactante pulmonar en el líquido amniótico se puede predecir la función respiratoria postnatal.
En la maduración pulmonar existe un desarrollo estructural que se relaciona con la formación del árbol traqueobronquial y alvéolos y un desarrollo funcional que se relaciona con la diferenciación celular del epitelio respiratorio, síntesis y secreción del surfactante por las células alveolares tipo II.
El surfactante pulmonar se sitúa tapizando la cavidad alveolar y modula la tensión superficial en la interfase aire/fluido durante el ciclo respiratorio.
Mediante esto, reduce la tendencia al colapso, disminuye el trabajo respiratorio, aumenta la CFR (capacidad funcional residual) y participa en la homeostasis del fluido alveolar y en los mecanismos de defensa. (1)
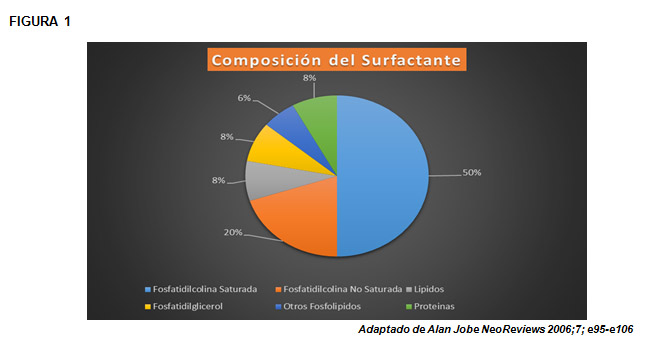
Composición química del surfactante
(Figura 1).
El surfactante pulmonar es un agente tensoactivo y antiedematoso.
El surfactante pulmonar es un líquido de naturaleza diversa, 90% de lípidos; 5-10% de proteínas y trazas de hidratos de carbono. (1)
La actividad tensoactiva la ejerce gracias al alto contenido de fosfolípidos (> 80%).
El que tiene mayor actividad es la dipalmitoil-fosfatidilcolina (lecitina no saturada).
El fosfatidilinositol (PI), el fosfatidilglicerol (PG) y otras sustancias estabilizan la lecitina en la película del alvéolo.
Las proteínas asociadas al surfactante son:
SP-A (5%): Es la más abundante asociada al surfactante. Tiene un PM (peso molecular) mayor que la SP-B y SP-C y juega un papel importante en el reciclaje del surfactante por los neumocitos tipo II.
Regula la inserción de los fosfolípidos en la monocapa. Presenta actividad innata defensiva. Es de carácter hidrofílica.
SP-B (2%): Es de bajo PM igual que la SP-C. Promueve la inserción de fosfolípidos en la interfase aire/líquido. Su ausencia determina pérdida de mielina tubular y un procesamiento inadecuado de SP-C.
Su déficit congénito (Enfermedad Autosómica Recesiva) puede producir un SDR (síndrome de dificultad respiratorio) fulminante en las primeras horas de vida. Es de carácter hidrofóbica.
SP-C (2%): Es una proteína de bajo PM.
Están relacionadas con las propiedades tensoactivas del surfactante promoviendo la inserción de fosfolípidos en la interfase aire/líquido.
Para su procesamiento requiere de SP-B.
Su ausencia produce un SDR moderado por alteración de la estabilidad del surfactante. Es de carácter hidrofóbica.
La SP-D (1%): Tiene una estructura y función defensiva similar a la SP-A y es de carácter hidrofílica. Su ausencia de ha relacionado con aumento del enfisema pulmonar (estudios en animales).
Biosíntesis
El surfactante pulmonar se sintetiza en el retículo endoplásmico de las células alveolares tipo II. Una vez formado se acumula en los cuerpos laminares que son organelos subcelulares característicos de estas células y a nivel de la subfase se secreta a la luz alveolar formando una capa mono molecular que tapiza el alvéolo, condición indispensable para la adaptación del recién nacido a la vida extrauterina.
El pulmón maduro tiene una rápida capacidad de síntesis de fosfolípidos tensoactivos. Sin embargo, el pulmón de un prematuro tiene enlentecida la capacidad de síntesis y reciclaje en el retículo endoplásmico. (1)
Algunas sustancias del organismo, incluyendo varias hormonas, estimulan la producción del surfactante pulmonar, entre ellas se encuentran los glucocorticoides, la prolactina, el estradiol y la tiroxina. Sin embargo, otras actúan como inhibidores de su producción, como la insulina y los andrógenos. Sin embargo, los corticoides administrados a las madres de fetos pretérminos son los que mejor rendimiento tiene. (2)
Corticoides y maduración pulmonar
En 1972, Liggins y Howle demuestran la eficacia de la administración de corticoides prenatal en la disminución de la incidencia de SDR en RN (recién nacidos) menores de 32 s. de gestación. (3)
Disminuye la morbilidad y mortalidad neonatal.
Se critican los riesgos potenciales sobre el RN como el alterar la respuesta inmunitaria, originar un deterioro intelectual, disminuir el tamaño del encéfalo del feto y peso de órganos y originar un retardo neurológico a largo plazo.
Sin embargo, el costo beneficio supera a los riesgos por lo que su uso actualmente no está en duda.
En 1990, Crowley y cols. presentan trabajo que consolida los beneficios de los corticoides maternos (12 ensayos= 3.000 mujeres). (4)
En ese estudio se usaron Betametasona 12 mg/ 24 h im/2 dosis, total 24 mg., Dexametasona 5 mg/12 h im/4 dosis, total 20 mg.,Hidrocortisona 500 mg/ 12 h ev/2 dosis, total 1000 mg. o Metiprednisolona 125 mg/ 12 h im/2 dosis, total 250 mg.
Crowley y cols. Muestran en este estudio una disminución de la morbilidad y mortalidad perinatal.
La disminución de la morbilidad respiratoria va entre el 40 al 60%, viendo beneficios en todas las edades gestacionales con o sin RPO (Rotura prematura ovular). (5)
- Reduce la incidencia de Neumotórax y Enfisema Intersticial.
- Se obtienen mayores beneficios en el niño que nace después de las primeras 24 horas del tratamiento y antes de los 7 primeros días postratamiento.
- Disminuye la incidencia de patología neurológica en un 39 % ya que se observa una disminución de la incidencia de HIV (Hemorragia intraventricular) pues aceleran la maduración de la matriz germinal.
- No aumenta el riesgo de infección materna ni del neonato.
- Disminuye la incidencia de ECN (Enterocolitis necrotizante).
Los más usados actualmente es la betametasona y luego la dexametasona.
Al comparar ambos corticoides, la dexametasona se asoció con un riesgo menor de HIV en comparación con betametasona (cociente de riesgos (RR) 0,44, intervalo de confianza (IC) del 95%: 0,21 a 0,92; cuatro ensayos, 549 neonatos). Pero no se observaron diferencias estadísticamente significativas para otros resultados primarios: síndrome de dificultad respiratoria (SDR) (RR 1,06; IC del 95%: 0,88 a 1,27; cinco ensayos, 753 lactantes) y muerte perinatal (muerte neonatal RR 1,41; IC del 95%: 0,54 a 3,67; cuatro ensayos, 596 neonatos). (6)
Se recomienda fuertemente el uso de corticoides entre 24 y 34 s. Siguiendo este protocolo de uso se obtiene un descenso
importante de la tasa de mortalidad neonatal y del período de estadía en los Servicios de Neonatología. (7)
Actualmente se está planteando ampliar el uso de corticoides a madres con embarazos de 34 a 37 s (pretérminos tardíos).
En comparación con los recién nacidos de 39 a 40 semanas de gestación, aquellos nacidos a las 34 semanas tenían un mayor riesgo de complicaciones respiratorias, incluyendo SDR / enfermedad de membrana hialina (OR: 40.1, IC 95%: 32.0-50.3), transitoria taquipnea del recién nacido (OR: 14.7, IC 95%: 11.7–18.4), neumonía (OR: 7.6, IC 95%: 5.2–11.2), insuficiencia respiratoria (OR: 10.5, IC 95%: 6.9–16.1), y necesidad de asistencia respiratoria (OR: 13.9, IC 95%: 11.0–17.6) . El riesgo de morbilidad pulmonar disminuyó con el avance de la edad gestacional.
Sin embargo, no hay una recomendación fuerte actualmente al respecto que avala tal planteamiento. (8)

Surfactante pulmonar exógeno
Los primeros estudios se remontan al período entre 1964 y 1967 pero estas fracasaron por haber sido en dosis pequeñas y además administradas en nebulización.
Enhorning en 1974 publica primeros resultados en animales administrando surfactante en la tráquea.
Fujiwara en 1980 publica primeros resultados en RN con mejoría evidente de la oxigenación. (10)
En 1990 FDA aprueba su uso en recién nacidos y empieza su uso universal.

El surfactante cambia la tensión superficial en la medida que la superficie alveolar se expande y se contrae. Cuando la superficie alveolar se expande, el surfactante llena la superficie, disminuyendo la tensión superficial. El Surfactante se concentra en la superficie durante la contracción (exhalación). La tensión superficial cae a medida que el surfactante llena la superficie alveolar. Como consecuencia de lo anterior, al aumentar la distensibilidad pulmonar, el surfactante cambia la curva presión/ volumen logrando un aumento del volumen pulmonar a igualdad de presiones en la vía aérea al comparar con un pulmón sin surfactante. (1,11)
Utilidades del uso de Surfactante Exógeno.
Existen muchos estudios (11) que demuestran que:
- Reduce la mortalidad por MH entre un 40 y 60 % y por lo tanto reduce la tasa de mortalidad de los prematuros.
- Reduce la incidencia de neumotórax y de enfisema intersticial entre un 30-65%.
- Disminuye el riesgo de H.I.V.
- No reduce el riesgo de DBP (Displasia broncopulmonar).
¿Cuál Surfactante usar?
Existen preparaciones derivadas de animal y otras sintéticas.
Naturales:
- Survanta ® o Beractant ® (pulmón de bovino).
- Curocerf ® o Surfacur ® (pulmón de porcino).
- Calfactant ® o Infasurf ® (pulmón de ternero).
Sintéticos:
- Exosurf ® (mezcla de lípidos sintéticos)
- Lucinactant ® (KL4).
Los metaanálisis han mostrado que el uso de surfactante derivado de animales en lugar del surfactante sintético libre de proteínas resultó en una reducción significativa en el riesgo de neumotórax [riesgo relativo típico (RR) 0.65, IC 95% 0.55 a 0,77; diferencia de riesgo típica (RD) -0.04, IC 95% -0.06 a -0.02; número necesario para tratar para beneficiar (NNTB) 25; 11 estudios, 5356 lactantes] y una reducción marginal en el riesgo de mortalidad (RR típico 0.89, IC 95% 0.79 a 0.99; RD típico -0.02, IC 95% -0.04 a -0,00; NNTB 50; 13 estudios, 5413 neonatos). (12,13)
Por lo tanto, en la actualidad se recomienda usar surfactantes de origen animal.
¿Cuándo administrarlo?
Profiláctico, se debe usar en los primeros 30 minutos y se usa en niños con riesgo de MH con o sin síntomas de SDR de acuerdo a las siguientes probabilidades.

Aunque los primeros ensayos de administración profiláctica de surfactante a recién nacidos que se consideran en riesgo de desarrollar SDR en comparación con el uso selectivo de surfactante en recién nacidos con SDR establecido demostraron una disminución del riesgo de escapes aéreos y mortalidad, recientes ensayos grandes que reflejan la práctica actual (incluida una mayor utilización de los esteroides maternos y la estabilización de rutina posterior al parto en CPAP) no respaldan estas diferencias y demuestran un menor riesgo de enfermedad pulmonar crónica o muerte cuando se usa la estabilización temprana en CPAP con administración selectiva de surfactante a bebés que requieren intubación. (14,15,16)
Por lo tanto, actualmente se recomienda usar inicialmente CPAP como estabilizador y de acuerdo a la evolución del SDR, administrar o no surfactante posteriormente si es que se supera la FiO2 de 0,30 y presiones superiores a 6 cm de H2O.

Los metaanálisis demostraron reducciones significativas en el riesgo de neumotórax (Típico RR 0,70; IC del 95%: 0,59 a 0,82; RD típico - 0.05, IC 95% - 0.08, - 0.03) y enfisema intersticial pulmonar (RR típico 0.63, IC 95% 0.43, 0.93; RD típico - 0.06, IC 95% - 0.10, - 0.01) en recién nacidos asignados al azar a la administración temprana de surfactante selectivo. También demostraron una disminución del riesgo de mortalidad neonatal (Típico RR 0,87; IC del 95%: 0,77 a 0,99; RD típica - 0.03, IC 95% - 0.06, - 0.00), enfermedad pulmonar crónica (RR típico 0.70, IC 95% 0.55, 0.88; RD típica - 0.03, IC 95% - 0.05, - 0.01), y enfermedad pulmonar crónica o muerte a las 36 semanas (RR típico 0.84, IC 95% 0.75, 0.93;RD típico - 0.06, IC 95% - 0.09, - 0.03).
Por lo tanto, la recomendación actual es que se debe administrar el surfactante exógeno en forma precoz más que en forma tardía. (17,18)
¿Cuántas dosis usar?
El metaanálisis de varios ensayos sugiere una reducción en el riesgo de neumotórax (riesgo relativo típico 0.51, IC 95% 0.30, 0.88; diferencia de riesgo típica-0.09, IC 95% -0.15, -0.02) y una tendencia hacia una reducción en el riesgo de mortalidad (riesgo relativo típico 0.63, IC 95% 0.39, 1.02; diferencia de riesgo típica -0.07, IC 95% -0.14, 00.00). La posibilidad de administrar múltiples dosis de surfactante a los recién nacidos con insuficiencia respiratoria continua por lo tanto conduce a un mejor resultado clínico y parece ser la política de tratamiento más efectiva. (19).
Se recomienda colocar una segunda dosis siempre que los parámetros clínicos, ventilatorios (PMVA y FiO2) y gasométricos así lo ameriten. (19,20,21)
¿Qué dosis usar?
Se estima que un RN sano tiene 100 mg de fosfolípidos por kilo.
Un RN con EMH tiene 4-5 mg de fosfolípidos por kilo.
Las dosis recomendadas varían entre 50 y 200 mg/kilo.
Los surfactantes que contamos en nuestro país son:
Beractant® o Survanta ® aporta 200 mg en 8 cc (se administra 4 cc por k= 100 mg por k).
Curocerf ® o Surfacur© aporta 200 mg/ k en 2.5 cc (se administra inicialmente 2.5 ml/k/dosis en profilaxis y 1.25 ml/k/dosis en las dosis siguientes).
Según el tipo de surfactante se repite la dosis cada 6 o 12 hrs. (20,21)
El análisis de costo-efectividad realizado en un estudio muestra cómo el tratamiento precoz con surfactante de Curocerf® o Surfacur® usando una dosis inicial de 200 mgrs/k en los recién nacidos prematuros con SDR, además de ser clínicamente más efectivo, se asocian con un costo ligeramente menor. (22)
¿Cómo administrarlo?
En la actualidad en nuestro país, la forma más frecuente de administrarlo es a través de la intubación endotraqueal. Sin embargo, se supone que desde el momento en que se intuba el RN para colocar el surfactante y adicionar presión positiva en la vía aérea del recién nacido, empieza el camino hacia la DBP. Por lo tanto, se han propuesto otras formas más inocuas de administrarlo, algunas como nebulización y otras con sondas colocadas más allá de las cuerdas vocales llamadas MIST (Minimally Invasive Surfactant Therapy) que usa un Angiocath 16 G o LISA (Less Invasive Surfactant Therapy) la cual usa una sonda de alimentación 4-5 Fr y una pinza Magill.(20)
La nebulización no ha logrado funcionar bien ya que la no se ha encontrado una forma de nebulizar a una presión que llega hasta la vía área profunda. De los estudios actualmente revisados muchas preguntas quedan aún sin respuesta: el posicionamiento adecuado del nebulizador en el circuito, la interfaz adecuada para el soporte respiratorio no invasivo durante la nebulización, la preparación y dosificación óptimas de surfactante y el grupo de recién nacidos prematuros que tienen más probabilidades de beneficiarse del surfactante en aerosol. Se necesitan ensayos controlados aleatorios, bien diseñados y con poder apropiado, multicéntricos (23).
Actualmente está en uso cada vez más frecuente, especialmente en Europa, un método mínimamente invasivo con una cánula en la vía aérea (LISA) por la cual se administra el surfactante. Un metaanálisis de seis estudios caso control evaluaron a LISA versus InSurE y cada uno versus intubación tardía o inmediata para el surfactante. LISA resultó en una disminución de los riesgos de DBP (RR = 0.71 [0.52-0.99]; NNT = 21), muerte o DBP (RR = 0.74 [0.58-0.94]; NNT = 15) y falla temprana de CPAP o requisitos de ventilación invasiva (RR = 0.67 [0.53-0.84]; NNT = 8 y RR = 0.69 [0.53-0.88]; NNT = 6). En comparación con InSurE, LISA disminuyó los riesgos de DBP o muerte (RR = 0.63 [0.44-0.92]; NNT = 11) y de falla temprana de CPAP (RR = 0.71 [0.53-0.96]; NNT = 11). Las morbilidades neonatales comunes no fueron diferentes. (24,25,26)
Recomendación final
- Los médicos debieran ofrecer un único ciclo de corticosteroides prenatales a todas las mujeres en riesgo de parto prematuro desde las 24 semanas hasta las 34 semanas de gestación idealmente al menos 24 h antes del nacimiento (A1).
- A los recién nacidos que presenten un SDR debieran recibir surfactante de una preparación natural derivada de animal (A1).
- Aquellos pacientes con SDR debieran recibir terapia de surfactante de rescate precoz lo antes posible. (A1). Sin embargo, en ocasiones se deberá administrarse el surfactante en la sala de atención inmediata, especialmen-te en los pacientes que necesitan intubarse para su estabilización (A1).
- Terapia con CPAP debiera iniciarse desde el nacimiento en todos los recién nacidos en riesgo de padecer SDR, como aquellos menores de 30 semanas de gestación que no necesitan intubación para estabilización (A1).
- Un protocolo que seguir debiera incluir el tratamiento con surfactante a aquellos niños que están en CPAP y están agravándose con FiO2 mayor a 0,30 y presión mayor de 6 cm de H2O (B2).
- El Curocerf® o Surfacur® en dosis inicial de 200 mgr/kg es mejor que dar 100 mgr /kg de Curocerf® o 100 mgr/kg de Beractant® o Survanta® en la terapia precoz de rescate. (A1)
- LISA es la forma actual preferida de administración del surfactante en recién nacidos que están en CPAP respirando espontáneamente, por clínicos que tengan experiencia con esta técnica. (B2)
- Una segunda y ocasionalmente una 3era dosis de surfactante se podría administrar si es que hay evidencia de persistencia de SDR tales como requerimientos altos de FiO2 y haber excluido otros problemas (A1).
Bibliografía
- Jobe A: Pharmacology review: why surfactant works for respiratory distress syndrome. Neoreviews 2006; e95.
- Polin RA, Carlo WA; Committee on Fetus and Newborn; American Academy of Pediatrics. Surfactant replacement therapy for preterm and term neonates with respiratory distress. Pediatrics 2014; 133: 156-63.
- Liggins GC, Howie RN. A controlled trial of antepartum glucocorticoid treatment for prevention of the respiratory distress syndrome in premature infants. Pediatrics 1972;50(4):515–25.
- Crowley PA. Antenatal corticosteroid therapy: a meta-analysis of the randomized trials, 1972 to 1994. Am J Obstet Gynecol 1995;173(1):322–35.
- Roberts D, Brown J, Medley N, Dalziel SR. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database of Systematic Reviews 2017, Issue 3. Art. No.: CD004454. DOI: 10.1002/14651858.CD004454.
- Brownfoot FC, Gagliardi DI, Bain E, Middleton P, Crowther CA. Different corticosteroids and regimens for accelerating fetal lung maturation for women at risk of preterm birth (Review). The Cochrane Collaboration and published in The Cochrane Library 2013, Issue 8
- Management of preterm labor. Practice Bulletin No. 171. American College of Obstetricians and Gynecologists. Obstet Gynecol 2016;128: e155–64.
- Saccone G, Berghella V. Antenatal corticosteroids for maturity of term or near-term fetuses: systematic review and meta-analysis of randomized controlled trials. BMJ 2016;355: i5044.
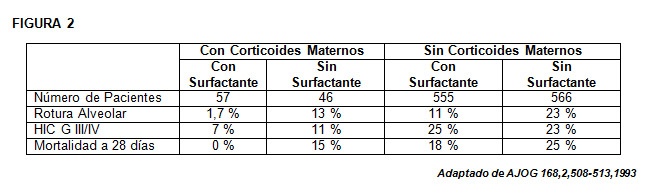
- Alan H. Jobe, MD, PhD, Brian R. Mitchell, MS,b and J. Harry Gunkel, MDb. Beneficial effects of the combined use of prenatal. corticosteroids and postnatal surfactant on preterm infants. Am J Obstet Gynecol 1993; 168:508-13.
- T Fujiwara, H Maeta, S Chida, T Morita, Y Watabe,T Abe. Artificial Surfactant Therapy in Hyaline-Membrane Disease. Lancet 1980 Jan 12;1(8159):55-9.
- Alan Jobe. Surfactant for Respiratory Distress Syndrome. Neoreviews 2014;15; e236.
- Seger N, Soll R. Animal derived surfactant extract for treatment of respiratory distress syndrome. Cochrane Database Syst Rev 2009;(2): CD007836.
- Stephanie Ardell, Robert H Pfister, Roger Soll. Animal derived surfactant extract versus protein free synthetic surfactant for the prevention and treatment of respiratory distress syndrome. Cochrane Database of Systematic Reviews 2015, Issue 5. Art. No.: CD000144
- Soll RF, Morley CJ. Prophylactic versus selective use of surfactant in preventing morbidity and mortality in preterm infants. Cochrane Database Syst Rev 2001: CD000510.
- Rojas-Reyes MX, Morley CJ, Soll R. Prophylactic versus selective use of surfactant in preventing morbidity and mortality in preterm infants. Cochrane Database Syst Rev 2012: CD000510.
- SUPPORT Study Group of the Eunice Kennedy Shriver NICHD Neonatal Research Network, Finer NN, Carlo WA, Walsh MC, Rich W, Gantz MG, et al. Early CPAP versus surfactant in extremely preterm infants. N Engl J Med 2010; 362:1970-9.
- Yost CC, Soll RF. Early versus delayed selective surfactant treatment for neonatal respiratory distress syndrome. Cochrane Database Syst Rev 2000;(2):CD001456.
- Bahadue FL, Soll R. Early versus delayed selective surfactant treatment for neonatal respiratory distress syndrome. Cochrane Database Syst Rev 2012; 11: CD001456
- Soll R, Özek E. Multiple versus single doses of exogenous surfactant for the prevention or treatment of neonatal respiratory distress syndrome (Review). Cochrane Library 2009, Issue 1.
- H.J. Niemarkt a M.C. Hütten b Boris W. Kramer. Surfactant for Respiratory Distress Syndrome: New Ideas on a Familiar Drug with Innovative Applications. Neonatology 2017; 111:408–414.
- David G. Sweet, Virgilio Carnielli, Gorm Greisen, Mikko Hallman et al. European Consensus Guidelines on the Management of Respiratory Distress Syndrome – 2019 Update. Neonatology 2019; 115:432–450.
- Carlo Dani, Roberto Ravasio, Leonardo Fioravanti and Maria Circelli. Analysis of the cost-effectiveness of surfactant treatment (Curosurf®) in respiratory distress syndrome therapy in preterm infants: early treatment compared to late treatment. Italian Journal of Pediatrics 2014, 40:40
- Stefan Minocchieri, Clare A Berry, J Jane Pillow on behalf of the CureNeb Study Team. Nebulised surfactant to reduce severity of respiratory distress: a blinded, parallel, randomized controlled trial. Arch Dis Child Fetal Neonatal Ed 2019;104: F313–F319.
- Vincent Rigo, Caroline Lefebvre, Isabelle Broux. Surfactant Instillation in Spontaneously Breathing Preterm Infants: A Systematic Review and Meta-Analysis. Eur J Pediatr 2016 Dec;175(12):1933-1942.
- Gyu-Hong Shim, MD. Update of minimally invasive surfactant therapy. Korean J Pediatr 2017;60(9):273-281.
- Jose C Aldana-Aguirre, Merlin Pinto, Robin M Featherstone, Manoj Kumar. Less invasive surfactant administration versus intubation for surfactant delivery in preterm infants with respiratory distress syndrome: a systematic review and meta-analysis. Arch Dis Child Fetal Neonatal Ed 2017;102: F17–F23
|

