Introducción
El Virus Respiratorio Sincicial (VRS) produce epidemias anuales en época invernal, causando un amplio espectro de manifestaciones clínicas que van desde infecciones asintomáticas hasta la muerte. El VRS es la causa más frecuente en pediatría de bronquiolitis y neumonía1. Casi la totalidad de los niños presentan una primoinfección por VRS antes de los 2 años, y la mitad de éstos tendrán más de un episodio. En menores de 3 meses hasta un 50% de los niños desarrolla bronquiolitis y/o neumonía, necesitando ser hospitalizados. En Chile, el VRS es la principal causa de hospitalización por infección respiratoria baja (IRAB), alcanzando cifras de alrededor de 70% en invierno, y se ha estimado en Chile que hasta un 2% de los niños menores de 2 años son hospitalizados por esta causa2. Los riesgos para desarrollar enfermedad severa durante la primoinfección por VRS son mayores en pacientes con antecedentes de prematuridad, displasia broncopulmonar, inmunosupresión, edad menor de 6 meses y cardiopatías congénitas3,5,6,7. En este último grupo, se ha visto mayor riesgo de hospitalización, asociado a un incremento en la morbimortalidad secundaria a infección por VRS4. Las tasas de letalidad en pacientes hospitalizados con cardiopatía congénita e infección por VRS ha sido reportado 24 veces más altas que en aquellos sin infección.10,11,12. A pesar de los avances en terapia intensiva, la letalidad en pacientes con cardiopatía congénita y VRS se sitúa en torno al 4%3.
En Chile no existen datos sobre las tasas de hospitalización o de complicaciones atribuibles a la infección por VRS en cardiopatías congénitas. Este dato es necesario en nuestro país ya que hoy existe prevención de infección por VRS con anticuerpos monoclonales –palivizumab - en pacientes con displasia broncopulmonar y prematuros extremos, y que son beneficiados mediante ley Ricarte Soto y a partir del 2019 en lactantes con cardiopatías congénitas hemodinamicamente significativas. El objetivo de este estudio fue establecer la tasa de letalidad en pacientes con cardiopatías congénitas hospitalizados por infección por VRS y cuantificar los días de hospitalización, necesidad de oxígeno, necesidad de admisión en unidad de paciente crítico, días ventilación mecánica, presencia de infecciones asociadas a la atención en salud, en un intento de conocer la necesidad de profilaxis en estos pacientes en nuestro medio.
Materiales y métodos
Se realizó un estudio descriptivo retrospectivo, mediante revisión de fichas clínicas de lactantes menores de 24 meses con cardiopatía congénita, hospitalizados debido a infección respiratoria baja por virus respiratorio sincicial, entre los años 2014 y 2016. Se registró edad, género, tipo de cardiopatía congénita, diagnósticos y/o morbilidades asociadas, días de hospitalización, ingreso a unidad de paciente crítico y letalidad en Hospital Roberto del Río. Los datos obtenidos fueron almacenados en una hoja de cálculo de Excel y analizados en forma anonimizada en el programa estadístico Stata 13, mediante el cual se realizó un análisis descriptivo a través de frecuencias absolutas y relativas para las variables categóricas, y con medidas de tendencia central y dispersión para las variables cuantitativas según la distribución de la variable. Se excluyeron a todos los lactantes menores de 24 meses hospitalizados debido a infección respiratoria baja causadas por otros virus (no VRS) y/o microorganismo no identificado mediante inmunofluorescencia directa. También se excluyó a lactantes mayores a 24 meses. El estudio contó con la aprobación del comité de ética del Servicio de Salud Metropolitano Norte.
Resultados
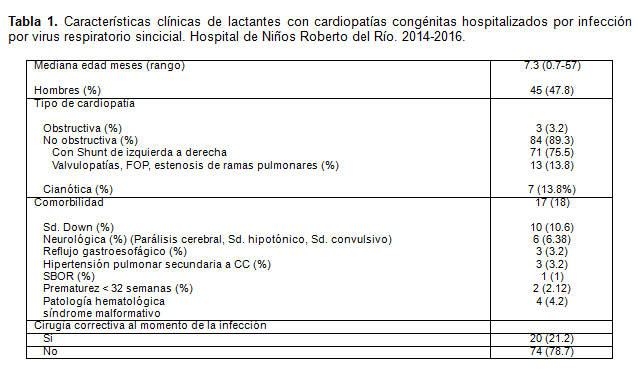
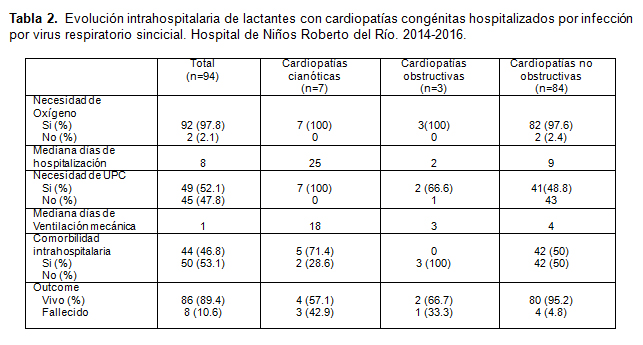
Entre los años 2014 y 2016 en el hospital de Niños Roberto del Río se hospitalizan un total de 94 pacientes menores de 2 años de edad portadores de cardiopatías congénitas, con infección respiratoria baja a causa del virus respiratorio sincicial. En la Tabla 1 se muestran las características de los pacientes estudiados. La mediana de edad es de 7,3 meses. Un 52% de ellos son hombres. Se agrupan tipos de cardiopatías congénitas en cianóticas, obstructivas izquierdas y no obstructivas, siendo estas últimas en donde se concentra la mayor cantidad de pacientes con un 89,4%. Se observa un 49% de comorbilidades siendo la mayoría trisomía 21. Le siguen patología neurológica y enfermedad por reflujo gastroesofágico. Se incluyen en este análisis hasta 3 patologías asociadas por paciente. Un 25% del total de pacientes fue sometido a procedimiento quirúrgico correctivo previo a la infección por VRS. La evolución intrahospitalaria se describe en la tabla 2. De los 94 pacientes, casi la totalidad requiere oxígeno en algún momento de la hospitalización, la mediana de hospitalización es de 8 días, sin embargo, hay gran dispersión de los datos, siendo la menor estadía intrahospitalaria de 1 día y la mayor de 127 días. Cabe destacar que los pacientes con cardiopatías cianóticas presentan mayor duración de hospitalización. Más de la mitad de los pacientes requiere ser ingresado a unidad de paciente crítico (UPC), de ellos la totalidad de los pacientes con cardiopatías cianóticas. Entre los pacientes que requieren hospitalización, aquellos con diagnóstico de cardiopatías cianóticas tienen una mediana de días de ventilación mecánica invasiva y no invasiva muy por sobre el promedio de los grupos restantes. Las comorbilidades intrahospitalarias ocurren en cerca de la mitad de los pacientes y abarcan principalmente sobreinfección bacteriana, o coinfección viral, siendo más frecuentes en el grupo de pacientes de cardiopatías cianóticas. La letalidad global es de 8,51%, mayor en cardiopatías congénitas cianóticas. La estadía intrahospitalaria, y el promedio de días de ventilación mecánica fue similar en los 2 grupos. Tabla 3. Tabla 4.
Discusión
Las infecciones respiratorias agudas (IRA) representan un problema de salud pública importante en todo el mundo. Las neumonías y bronquitis obstructivas son la principal causa de hospitalización en lactantes, especialmente durante las estaciones frías y la primera causa de mortalidad en niños entre 1 mes y 4 años2. Casi la totalidad de los niños se infectan con el VRS durante los 2 primeros años de la vida. Generalmente la infección se presenta como una infección respiratoria alta leve, pero hasta el 2% de los lactantes requiere ser hospitalizado en el área norte de Santiago. La epidemia de VRS ocurre cada año en los meses de invierno, durando en promedio entre 3.5 y 5.5 meses y se extiende entre mayo y septiembre en Chile. El rol del VRS como agente causante de enfermedad severa en pacientes con factores de riesgo tales como prematurez, displasia broncopulmonar, inmunosupresión, menores de 6 meses y cardiopatías congénitas está ampliamente estudiado y demostrado según la literatura nacional e internacional3,4,5,6,7.
En este estudio se analizaron 94 pacientes con cardiopatías congénitas hospitalizados por infección respiratoria baja por VRS, observándose una letalidad de un 8,51%, requiriendo ingreso a unidad de paciente crítico (UPC) un 52%; estas cifras se sitúan sobre el promedio en comparación con la literatura internacional1,9,10,13. Geoghegan et al reportó en 32 pacientes una letalidad de 6.25% y el grupo del Dr L.Bont 0-3,3% en 10 pacientes, con necesidad de UPC en 50%10,13. El promedio de días de hospitalización en nuestra serie fue también mayor de 13.01(1-127), comparao con 6.6 dias (2-41) en el grupo de L. Bont13.
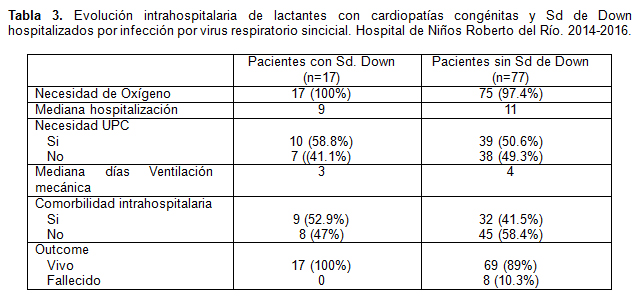
Cabe mencionar además que el 18.08% de los pacientes estudiados eran portadores de trisomía 21, los cuales evolucionaron en su totalidad con requerimientos de oxígeno, más de la mitad ingresó a cuidados intensivos y un 52.94% presentó alguna infecció asociada a atención de salud, en comparación al 42,55% de los pacientes sin este diagnóstico. Es interesante destacar que en este grupo de pacientes con Sindrome de Down, el promedio de edad fue de 9,87 meses, y la totalidad de ellos con diagnóstico de cardiopatía congénita no obstructiva no tuvieron mortalidad asociada, lo que pudiera estar en relación al tipo de cardiopatía presente. Las complicaciones causadas por la infección por VRS en niños con cardiopatía se correlacionan con la gravedad de la enfermedad cardíaca subyacente. Las repercusiones sistémicas a su vez son representadas por el grado de compromiso de la función cardiovascular, mecánica pulmonar de flujo/ventilación, grado de cianosis, nivel de hipertensión pulmonar y presencia de edema pulmonar agudo4.
La prevención del VRS se basa en la educación de los padres sobre la importancia de reducir la exposición del niño a la infección y la profilaxis pasiva. Desde 1996 existe disponible la inmunoglobulina endovenosa (RSV- IGIV)14,15 y los anticuerpos monoclonales humanizados preparados sobre la glicoproteína F del VRS (palivizumab, Synagis ®). La US Food and Drug Administration (FDA) aprobó el uso de palivizumab en 1998 para la prevención de la IRAB por VRS en niños de alto riesgo, en administración mensual intramuscular. Los resultados de dos ensayos terapéuticos randomizados controlados doble ciego con palivizumab que incluyeron 2789 lactantes y niños prematuros, con DBP o cardiopatías congénitas demostraron una reducción de la tasa de hospitalización por VRS de 39% a 78% en diferentes grupos. Los resultados de estudios observacionales, sugieren que la inmunoprofilaxis mensual con palivizumab podría reducir las tasas de hospitalización por IRAB por VRS incluso mayores (70%) que las reportadas en los ensayos clínicos controlados. La Academia Americana de Pediatría ha publicado guías clínicas para la selección de pacientes de alto riesgo que se beneficiarían con la inmunoprofilaxis mensual con Palivizumab18.
Es claro que la profilaxis con Palivizumab es beneficiosa, en lactantes con cardiopatías congénitas hemodinámicamente significativas, reportando una reducción de 45% en hospitalizaciones, un 56% en el total de días de hospitalización y un 73% en los requerimientos de oxígeno suplementario.19 La letalidad en el grupo que recibió palivizumab fue de 3.3% comparada con 4.2% en el grupo placebo. Las reacciones adversas fueron similares en ambos grupos, ninguno atribuible a Palivizumab. En la población de pacientes analizados en el estudio IMPACT es necesario tratar 16 pacientes con palivizumab para evitar una hospitalización7. El impacto económico ha sido evaluado con estudios de costo-efectividad, con diferentes efectos medidos: reducción del número y días de hospitalizaciones y años de vida ganados. En Chile no existen datos sobre las tasas de hospitalización o de complicaciones atribuibles a la infección por VRS en cardiopatías congénitas. Este dato es necesario en nuestro país ya que hoy existe prevención de infección por VRS con anticuerpos monoclonales –palivizumab- en pacientes con displasia broncopulmonar y prematuros extremos, y que son ley Ricarte Soto. Para implementar a nivel nacional el uso de anticuepos monoclonales en este grupo de pacientes con cardiopatías congénitas era necesario contar con datos nacionales. Este estudio a nivel local en un centro de referencia cardiológico aporta a este conocimiento y permitirá tener una base de comparación para la política implementada el 2019.
En conclusión, este estudio demuestra la alta tasa de letalidad de la infección por VRS en lactantes con cardiopatías congénitas, especialmente en el grupo con cardiopatías congénitas obstructivas y cianóticas.
Referencias
- Respiratory Syncytial Virus Infection and Bronchiolitis. Giovanni Piedimonte, MD, Miriam K. Perez, MD. Pediatrics in Review Vol. 35 No. 12 December 1, 2014 pp. 519 -530
- Severidad clínica de la infección respiratoria aguda baja primaria por virus respiratorio sincicial grupos A y B. María Angélica Palomino et al. Rev Chil Pediatr 75 (Supl); S18-S24, 2004
- Palivizumab prophylaxis reduces hospitalization due to respiratory syncytial virus in young children with hemodynamically significant congenital heart disease. Feltes TF, Cabalka AK, Meissner HC, Piazza FM, Carlin DA, Top FH Jr, Connor EM, Sondheimer HM; Cardiac Synagis Study Group. J Pediatr. 2003 Oct;143(4):532-40
- Respiratory syncytial virus infection in children with congenital heart disease: global data and interim results of Korean RSV-CHD survey. Jo Won Jung, M.D. Korean J Pediatr 2011;54(5):192-196
- Social, economic, and health impact of the respiratory syncytial virus: a systematic search. Díez-Domingo et al. BMC Infectious Diseases. 2014,14:544
- Risk factors for severe respiratory syncytial virus infection in infants. Y. AUJARD y B. FAUROUX. Respiratory medicine Vol.96(2002) (SUPPLEMENTB), S9-S14
- Aujard Y, Fauroux B. Risk factors for severe respiratory syncytial virus infection in infants. Respir Med 2002;96:S9-14.
- Shay DK, Holman RC, Roosevelt GE, Clarke MJ, Anderson LJ. Bronchiolitis-associated mortality and estimates of respiratory syncytial virus associated deaths among US children, 1979-1997. J Infect Dis 2001;183:16-22.
- Global respiratory syncytial virus-associated mortality in young children (RSV GOLD): a retrospective case series. Scheltema, Nienke M et al. The Lancet Global Health ,Volume 5 , Issue 10 , e984 - e991
- Geoghegan, Erviti, Caballero, et al.: Mortality in Infants with Respiratory Syncytial Virus. Am J Respir Crit Care Med Vol 195, Iss 1, pp 96–103, Jan 1, 2017
- Boyce TG, Mellen BG, Mitchel EF, Wright PF, Griffen MR. Rates of hospitalization for respiratory syncytial virus among children in Medicaid. J Pediatr 2000;137:865-70.
- Shay DK, Holman RC, Newman RD, Liu LL, Stout JW, Anderson LJ.Bronchiolitis-associated hospitalizations among US children. JAMA 1999;282:1440-6.
- Checchia PA, Paes B, Bont L, Manzoni P, Simões EA, Fauroux B, Figueras-Aloy J, Carbonell-Estrany X. Infect Dis Ther. 2017 Mar;6(1):37-56. doi: 10.1007/s40121-016-0142-x. Epub 2017 Jan 9. Review.
- Meissner HC, Groothuis JR, Immunoprophylaxis and the control of respiratory syncytial virus disease. Pediatrics 1997; 100; 260-263.
- Meissner HC, Long SS. Revised indications for the use of palivizumab and respiratory syncycial virus immune globulin intravenous for the prevention of respiratory syncycial virus infection. Pediatrics 2003; 112;pp 1447-1452.
- 16.Romero J.R. Palivizumab prophylaxis of respiratory syncycial virus disease from 1998 to 2002: results from four years of palivizumab usage. Pediatr Infect Dis J 2003; 22: S46-S54.
- The IMPACT RSV study group, Palivizumab, a humanized RSV monoclonal antibody, reduces hospitalization from RSV infection in high-risk infants. Paediatrics 1998;102:531-7.
- American Academy of Pediatrics, Commitee on Infectious Diseases and Commitee on Fetus and Newborn, Prevention of respiratory syncytial virus infections:indications for the use of palivizumab and update on the use of RSV-IGIV, Pediatrics 1998;102:1211-1216.
- Feltes TF, Cabalka AK, Meissner HC, and Cardiac Synagis study group Palivizumab prophylaxis reduces hospitalization due to respiratory syncytial virus in young children with hemodynamically significant congenital heart disease. J Pediatr (2003) 143:pp 532-540
|

