Introducción
La infección del tracto urinario (ITU) se define como la colonización, invasión, y proliferación bacteriana del tracto urinario, puede comprometer desde la vejiga (cistitis o ITU baja), hasta el parénquima renal, ITU alta o Pielonefritis aguda (PNA), asociado a leucocituria y sintomatología clínica variable.(1)
Es una de las infecciones bacterianas más frecuentes en la edad pediátrica. Su prevalencia se ha descrito en un 7% de los menores de 2 años con fiebre sin foco.(2) A menor edad, los síntomas suelen ser más vagos y el examen físico inespecífico, siendo la fiebre, como síntoma único, la forma de presentación más común en lactantes.(3)
La mayoría de las infecciones son causadas por Escherichia coli (>75%), aunque en el primer año de vida otras enterobacterias son más frecuentes que a mayor edad.(4)
El tratamiento antibiótico puede ser administrado vía oral o parenteral, dependiendo de la edad y condiciones clínicas asociadas. La indicación de hospitalización está restringida a niños con riesgo de bacteriemia, mala tolerancia oral o que no puedan manejarse correctamente de manera ambulatoria.(1)
La elección del tratamiento dependerá de la resistencia local. La resistencia antibiótica de las enterobacterias ha mostrado un aumento persistente en los últimos 15 años.(5) El 2019 los agentes causantes de ITU en nuestra Unidad de Emergencia Hospitalaria (UEH) presentaron una sensibilidad de un 50% a las cefalosporinas de primera generación y menos de un 70% de sensibilidad al cotrimoxazol, por lo que estos antibióticos ya no son considerados una alternativa válida como tratamiento empírico de la PNA.
Como alternativas de tratamiento en pacientes ambulatorios se encuentran las cefalosporinas de segunda o tercera generación vía oral y la amikacina o ceftriaxona endovenosas. Sin embargo, se debe considerar también la creciente resistencia a través de Beta-lactamasas de espectro extendido (BLEE) descrita cada vez más frecuente en niños.(6)
Se recomienda reevaluar a todo paciente 48 horas luego del inicio de antibióticos, para además de vigilar la evolución clínica, realizar ajuste antibiótico según antibiograma.(1)
En nuestro medio se encuentra como alternativa de manejo el uso de amikacina endovenosa, aminoglucósido ampliamente disponible, con índices bajos de resistencia microbiana y de bajo costo pero con el inconveniente que requiere monitorización de función renal y medición de niveles en sangre en caso de tratamientos prolongados debido a su nefrotoxicidad.(7) Para el manejo ambulatorio vía oral, el tratamiento de elección, las cefalosporinas de segunda y tercera generación, tienen el inconveniente de poseer un alto costo e inducir mayor resistencia en la microbiota bacteriana .
Un estudio prospectivo realizado entre 2003 y 2005 en el Hospital Dr. Sotero del Rio comparó el tratamiento hospitalizado de lactantes con ITU febril con el manejo endovenoso ambulatorio realizado en la unidad de emergencia, demostrando que este último, fue efectivo, seguro y de menor costo.(8)
Teniendo en cuenta además la escasez de camas pediátricas, sobretodo en períodos de invierno donde hay un aumento exponencial de consultas y hospitalizaciones por causa respiratoria, es que surge la necesidad de un protocolo de manejo, que sea seguro y aplicable a la realidad de nuestro hospital. El año 2018 en la UEH de nuestro centro se implementa el protocolo de manejo ambulatorio de ITU febril, que incluye a pacientes entre 3 meses y 2 años de edad, el cual consiste en la administración diaria de amikacina endovenosa en la UEH con la opción, según decisión de los tutores, de mantener la vía venosa periférica en domicilio (evitando múltiples punciones) con posterior ajuste a antibiótico oral según antibiograma cuando este se encuentre disponible.
El objetivo de este estudio es describir las características clínicas, de laboratorio y microbiológicas de los pacientes que recibieron tratamiento ambulatorio de ITU febril con amikacina en la UEH del Hospital Dr. Roberto del Río durante los años 2018 y 2019 y describir además lo motivos de fracaso de este manejo.
Pacientes y Métodos
Estudio descriptivo, retrospectivo en la UEH del hospital de niños Dr. Roberto del Río. Se utilizó la base de datos de consultas pediátricas de la UEH, entre el 1 de Enero de 2018 y el 31 de Diciembre de 2019. Se filtró según edad objetivo, 3 meses y 2 años, y posteriormente según diagnóstico de egreso principal considerando como posibles opciones según clasificación CIE 10 los siguientes: Infección de vías urinarias (N39.0), Disuria (R30.0) y Pielonefritis crónica (N11.1). Se registraron las características clínicas, de laboratorio y microbiológicas de los pacientes a través de revisión de datos de atención de urgencia (DAU), exámenes de laboratorio y urocultivos, atenciones en policlínico de pediatría del hospital y/o Epicrisis. Para determinar la presencia de molestias urinarias se consideraron conductas como tocarse el pañal o genitales frecuentemente y/o quejido o llanto al orinar referidas por el acompañante.
Los criterios de inclusión fueron: fiebre (Temperatura axilar ≥ 38ºC), leucocituria (10 o más leucocitos/mm3), Urocultivo (UC) positivo definido como ≥ 10.000 ufc/ml en muestras por cateterización vesical y ≥ 100.000 ufc/ml en muestras tomadas por recolector o “clean catch” (orina recolectada en la mitad del chorro miccional) y haber recibido tratamiento con amikacina endovenosa o intramuscular según protocolo. Como criterios de exclusión se definieron: diagnóstico o inicio de tratamiento fuera de la UEH, hospitalización al diagnóstico, indicación médica de antibiótico vía oral desde el diagnóstico y suspensión por indicación médica del manejo ambulatorio con amikacina ya iniciado. Se definió como abandono todo paciente que iniciado manejo ambulatorio con amikacina no completa protocolo hasta ajuste de tratamiento vía oral según antibiograma, y como fracaso a todo paciente que iniciado tratamiento ambulatorio requiere hospitalización durante su evolución.
El análisis estadístico se realizó en Stata 13.1 a través de frecuencias absolutas y relativas para variables categóricas y de tendencia central y dispersión para variables cuantitativas, según su distribución. Para la comparación de variables categóricas se usó Chi cuadrado y para variables cuantitativas Test de Mann-Whitney y T test, según su distribución.
Resultados
Dentro del periodo de estudio se encontraron 584 lactantes egresados de la UEH con diagnóstico de ITU alta. De estos fueron excluidos 129 pacientes, 58 por presentar UC negativo o no significativo, 29 fueron hospitalizados al diagnostico (las causas principales para esta conducta fueron el aspecto tóxico y la presencia de malformaciones de la vía urinaria), en 15 pacientes se indicó tratamiento antibiótico vía oral desde el diagnóstico (la principal razon fue la dificultad de acceso al hospital), en 14 casos se diagnosticó o inició tratamiento fuera de la UEH, en 3 pacientes el protocolo fue suspendido por decisión medica al considerarlos con baja probabilidad de corresponder a ITU y en 3 casos el tutor rechazó el tratamiento luego del diagnóstico. De todos los pacientes que iniciaron manejo según protocolo, 7 abandonaron el tratamiento, lo que corresponde al 1.53% del total, 4 de ellos recibieron al menos 3 dosis de amikacina, sin embargo, no acudieron para ajuste a tratamiento via oral, 3 de ellos tienen registrada una única consulta.
Finalmente 455 pacientes fueron ingresados al estudio. La mediana de edad fue 10,09 meses, con un mínimo de 3 y máximo de 23,3 meses. El 70,55% fue de sexo femenino. En el 53% (N=242) la fiebre fue el único sintoma y el 36,5% (N=166) presentaban nitritos positivos en orina.
Con respecto a la evolución clínica, 31 pacientes (6,8%) se consideraron como fracaso requiriendo hospitalización, los otros 424 pacientes (93,2%) fueron considerados como exitosos ya que completaron el protocolo de tratamiento.
Las características clínicas y de laboratorio del total de los pacientes y su comparación según evolución se observan en la Tabla Nº1. Al comparar ambos grupos, éxito y fracaso, solo la diferencia entre la leucocituria y el porcentaje de segmentados fue estadísticamente significativo.
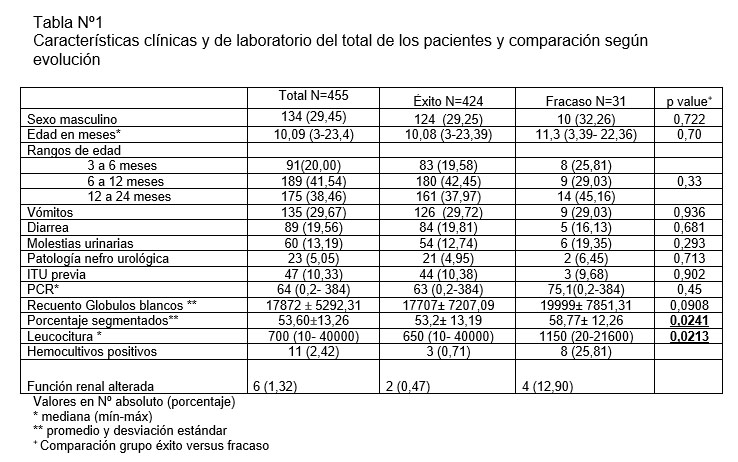
Del total de la muestra, 24 pacientes no contaban con control de PCR, a 23 no se les solicitó hemograma, 50 no tenían hemocultivos tomados, y a 49 no se le solicitó control de función renal (creatinina plasmática), todos del grupo exitoso, excepto un paciente hospitalizado que no registra control de función renal.
Sólo un 1,53% de los pacientes (N= 7) cursaron con una bacteriemia asociada a un bacilo Gram negativo (BGN), todos E.coli, solo 2 de estos pacientes no se hospitalizaron.
En 2 casos se aislaron estafilococos coagulasa negativos, interpretados como contaminación al recibir el resultado de la tipificación, uno ya hospitalizado, el otro de manejo ambulatorio. Un S. pyogenes fue aislado en el hemocultivo de un paciente cursando con una amigdalitis concomitante al dignóstico de ITU y un hemocultivo fue informado con un BGN no identificable a las 34,8 hrs, interpretado como contaminación.
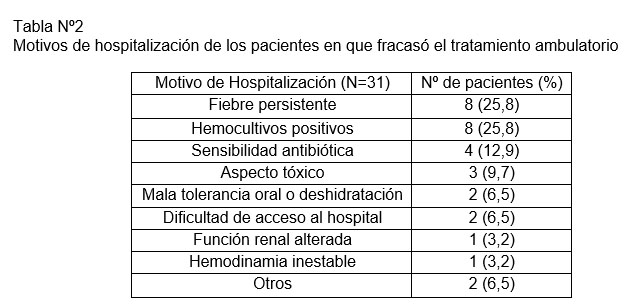
Los motivos de hospitalización de los pacientes en que fracasó el tratamiento ambulatorio se detallan en la Tabla Nº2. Se registraron solo 4 casos en que la sensibilidad antibiótica fue la causa de la hospitalización, correspondiendo todos a pacientes con infecciones por E. coli BLEE positivas en conjunto con resistencia a cotrimoxazol. Los motivos descritos como otros, corresponden a un paciente que presentó una convulsión febril compleja y otro que cursó con invaginación intestinal asociada. La mediana de dosis de amikacina recibidas previa hospitalización fue de 3, con un mínimo de 1 y un máximo de 4. Todos ellos, independiente de la causa, tuvieron evolución clínica favorable requiriendo solo manejo en sala básica. Se mantuvieron hospitalizados entre 2 y 12 días, con una mediana de 3. Se realizó ecografía abdominal y/o renal a 25 de los pacientes durante la hospitalización, en un caso se requirió Tomografía computada (TC) como método diagnóstico. En 16 pacientes la Ecografía resultó normal, en 4 se encontraron signos de PNA, en 2 casos alteraciones pielocaliciales, en una se observó Hidronefrosis bilateral y efectivamente en 3 de ellos se diagnosticó una ITU complicada con absceso renal o nefronia, los 3 con clínica de fiebre persistente. El hallazgo de nefronia se hizo con TC teniendo ecografía previa normal.
El 94% de las muestras de orina fueron tomadas por sondeo vesical, 4,6% por recolector y 1,3% por clean catch.
El microorganismo más frecuentemente aislado fue E. coli, todos los microorganismos se detallan en la Tabla Nº3.
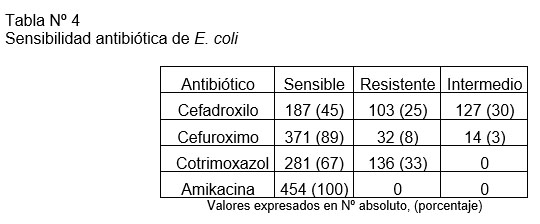
Se encontró un 100% de sensibilidad a la amikacina dentro de los microorganismos aislados (excepto E. faecalis). La sensibilidad antibiótica de E. coli, se detalla en la Tabla Nº4. El 6,8% de las bacterias aisladas, todas E. coli (N=31), presentaron resistencia a través de BLEE. El 64% de estas (N=20) mostraban resistencia conjunta a cotrimoxazol.

En los pacientes que completaron el tratamiento ambulatorio la mediana de dosis de amikacina recibidas en la UEH fue de 3, con un mínimo de 2 y un máximo de 7. 27 pacientes (6,4%), completaron el tratamiento de manera ambulatoria recibiendo 7 dosis de amikacina endovenosa sin necesidad de traslape a tratamiento vía oral. De estos casos la mayoría fueron pacientes en que se aisló E. coli con resistencia dada por BLEE, le siguen pacientes con mala tolerancia oral y un paciente que presentó una reacción alérgica a cefuroximo. En el 38,2% (N=162) se optó por cefadroxilo como tratamiento via oral, en 31,4% (N=133) por cotrimoxazol, en 22,4% (N=95) cefuroximo, 1,2% (N=5) por cefpodoximo y amoxicilina en los 2 casos de E. faecalis.
Discusión
La ITU es una infección bacteriana frecuente en el periodo de lactante. En un reciente metaanálisis los grupos con mayor prevalencia fueron los niños menores de 3 meses no circuncidados y las niñas menores de un año, encontrándose sobre los 3 meses mayor prevalencia del sexo femenino en todas las edades.(2) En nuestra serie, concordante con la literatura, el porcentaje de pacientes de sexo femenino fue el predominante. Dado que los menores de 3 meses tienen, según el manejo local indicación de hospitalización, es un rango etario no evaluado en este trabajo. Como se describe en la literatura, la forma de presentación en la mayoría de los pacientes de nuestra serie, fue únicamente fiebre.
El diagnóstico de ITU es bacteriológico, siendo fundamental tener una muestra de orina fiable para evitar errores diagnósticos y procedimientos innecesarios. En pacientes sin continencia urinaria, como nuestra serie, guías clínicas de diversos países (1,4,9,10,11,12) recomiendan la toma de muestra de orina por cateterismo vesical, si bien es una técnica molesta para el niño, presenta bajo riesgo de complicaciones, aunque también es susceptible de contaminación con tasas reportadas entre un 9 y 12%.(1)
La toma de muestra de orina en este estudio fue realizada por cateterismo vesical en el 94% de los casos, evidenciando que el diagnóstico se realizó según lo recomendado en la mayoría de los pacientes.
Si bien los exámenes de laboratorio como hemograma, proteína C reactiva (PCR) y procalcitonina orientan al diagnóstico de PNA cuando se encuentran elevados, no influyen en el manejo ni en la terapia antibiótica.(1,13) Se ha descrito que la Procalcitonina tiene mayor especificidad que la PCR para ITU con compromiso de parénquima.(4) Sin embargo en nuestro centro no se encuentra disponible.
El control de función renal no está recomendado de rutina a menos que se sospeche una ITU complicada o se requiera tratamiento aminoglucósido por más de 48 horas.(1,13) Debido a esto, se incluyó en el protocolo el control de función renal. En esta serie se encontró alterada en un 1,32% del total. Como es esperable, en aquellos pacientes que se hospitalizaron, este porcentaje se eleva a un 12,9%, ya que frente a este hallazgo se prefiere el uso de cefalosporinas de tercera generación endovenosas como tratamiento inicial.
En la edad pediátrica se observa un mayor riesgo de urosepsis que en la edad adulta.(4) En esta serie solo un 1,53% del total de los pacientes presentaron bacteriemia por un BGN, en contraste con la literatura, donde se reporta en un 4 – 9% de los lactantes con ITU febril. Los menores de 3 meses, aquellos con aspecto tóxico o séptico o con malformaciones del tracto urinario son los de mayor riesgo de esta presentación.(1,11) Lo anterior podría explicar el bajo porcentaje descrito en esta serie debido a que aquellos que estaban en los grupos de riesgo fueron en su mayoría hospitalizados en la primera consulta.
El porcentaje de pacientes que presentaron fracaso del tratamiento ambulatorio fue menor a un 10%. Al comparar las caracteristicas clínicas de los grupos fracaso versus éxito de tratamiento ambulatorio, ninguna de estas presentó una diferencia significativa en el análisis. Con respecto a los resultados de laboratorio, a pesar de las diferencias encontradas tanto en el valor de la PCR, como en el recuento de globulos blancos, solo el porcentaje de segmentados en el hemograma y la leucocituria fueron estadísticamente significativas. Mayores estudios son necesarios para verificar asociación entre alguna de las características y el fracaso al tratamiento. Dentro de este analisis no se consideraron la presencia de hemocultivos positivos ni la alteración de la función renal por ser ambas condiciones clínicas en que generalmente se prefiere ante su hallazgo el manejo hospitalizado.
El microorganismo más frecuentemente aislado fue Escherichia coli, concordante con la literatura nacional e internacional.(3,10,14,15) Le siguen en frecuencia otros BGN como K. pneumoniae y P. mirabilis.
Un reporte chileno del año 2012, analizó la susceptibilidad antibiótica en múltiples centros asistenciales de nuestro país, incluyendo nuestro hospital. En la población pediátrica el estudio de susceptibilidad de urocultivos ambulatorios arrojó un 98,5% de sensibilidad a amikacina, 70,3% cotrimoxazol y 58,8% a cefalotina.(16) La susceptibilidad de E. coli en los urocultivos tomados en la UEH de nuestro centro durante el año 2019, muestra una sensibilidad a cefadroxilo de un 50,2%, cefuroximo 93,9%, 67,5% cotrimoxazol y 99,9% a amikacina. En nuestra serie tanto el cefadroxilo como el cefuroximo muestran una menor sensibilidad en comparación, tanto con lo reportado en la literatura como con la sensibilidad previamente reportada de nuestra UEH. Cotrimoxazol mantiene una sensibilidad similar a lo reportado y para amikacina no se encontró resistencia en este grupo.
El patrón de resistencia de los BGN en base a BLEE ha ido en aumento en los últimos años.(6) En un Hospital pediátrico de EEUU se analizaron las ITU de manejo ambulatorio entre los años 2012 y 2016, encontrándose una prevalencia de E. coli productora de BLEE de un 7 a un 15%, con un 72% de resistencia a cotrimoxazol asociada. Se describe además que el uso de antibióticos en los 3 meses previos al diagnóstico fue un factor de riesgo para presentar este mecanismo de resistencia.(17) En nuestra serie se reporta un 6,81% de E. coli con resistencia dada por BLEE con un 64,5% de resistencia a cotrimoxazol asociada, encontrándose solos 2 pacientes que presentaban resistencia a cefalosporinas de segunda y tercera generación en base a un mecanismo no dado por BLEE. La asociación con uso de antibióticos es una variable no investigada, que sería interesante incluir en futuros trabajos. Afortunadamente el resultado clínico de pacientes con infecciones causadas por bacterias productoras de BLEE, ha sido similar al descrito en infecciones causadas por bacterias no multirresistentes, situación también observada en nuestra serie.(18)
Al comparar el tratamiento antibiótico endovenoso con el tratamiento vía oral, diversos estudios han demostrado que no existen diferencias en el resultado clínico de los pacientes, tanto en la duración de la fiebre, como en el desarrollo de complicaciones a futuro.(9,13,19) Por lo tanto, se recomienda actualmente el inicio de tratamiento oral en niños mayores de 2 a 3 meses de aspecto no tóxico, sin malformaciones de la vía urinaria conocida, cuando se pueda asegurar la tolerancia al medicamento y el seguimiento a las 48 horas. La recomendación de tratamiento endovenoso se mantiene ante la sospecha de ITU complicada.(1,9,13) En este estudio, uno de los principales motivos de fracaso del tratamiento ambulatorio fue la fiebre que persistía a las 48-72 horas de iniciado el tratamiento. En 3 casos se objetivó una complicación en las imágenes realizadas durante la hospitalización.
Con respecto al manejo de la bacteriemia, otro de los principales motivos de hospitalización en nuestra serie, la Rama de Nefrología de la Sociedad Chilena de Pediatría recomienda completar al menos 5 días de tratamiento antibiótico endovenoso.(1) En nuestra serie la mayoría de los pacientes que presentaron hemocultivos positivos se hospitalizaron, cuando en este informaba un BGN. Sólo 2 pacientes continuaron el tratamiento ambulatorio con amikacina por la evolución clínica favorable y la posibilidad de seguimiento clínico diario.
La mayoría de los pacientes que completaron el protocolo de tratamiento recibieron 3 dosis de amikacina previo a ajuste antibiótico via oral. Sin embargo, 27 pacientes recibieron el tratamiento completo de forma ambulatoria en la UEH, con 7 dosis de amikacina endovenosa. Como principales motivos se encuentran las infecciones dadas por microorganismos multirresistentes y la mala tolerancia oral. Pese a esto, debemos señalar que esta no es la conducta recomendada, ya que en tratamientos prolongados con aminoglicósidos se recomienda realizar control de función renal y niveles plasmáticos de antimicrobianos, siendo esta última una prestación no disponible en la UEH. Luego de algunos meses de implementado el protocolo, la situación antes descrita se hace evidente y se instruye al personal médico preferir la hospitalización para el manejo de estos casos.
Actualmente se recomienda para el tratamiento inicial de PNA preferir el uso de cefalosporinas de 2º o 3º generación vía oral, amikacina o ceftriaxona cada 24 horas en los servicios de urgencia como tratamiento,(1) tal como se realiza en nuestro protocolo. Para el caso de nuestra población, evaluando la sensibilidad evidenciada cercana al 90%, el uso de cefuroximo sería una alternativa válida de tratamiento empírico en pacientes que tienen buena tolerancia oral, sin embargo debemos tener en cuenta la inducción de resistencia que conlleva su uso.
Otro punto a destacar es el consenso en múltiples guías clínicas,(1,9,13) que en caso de optar por tratamiento antibiótico vía oral, se debe garantizar el control clínico y el ajuste antibiótico con antibiograma dentro de 48 horas de iniciado el tratamiento, posibilidad muchas veces difícil en nuestro medio, por lo que el control clínico diario en la UEH es una opción válida que permite asegurar el seguimiento clínico necesario y oportuno.
Gracias a la responsabilidad de los padres, requiriendo su compromiso de asistir a la UEH diariamente por al menos 3 días seguidos y el cuidado de la vía venosa en su domicilio, en este estudio se objetivó un porcentaje bajo de abandono, menos del 2% del total de pacientes.
Desde Mayo de 2020, en contexto de la pandemia por COVID-19, y para evitar la sobreexposición de los pacientes y sus familias al contagio, el protocolo de tratamiento ambulatorio fue modificado a la administración de una dosis de amikacina en la primera consulta y la entrega por parte del hospital del tratamiento antibiótico con cefuroximo vía oral e indicación de control a las 48 - 72 horas en el policlínico de pediatría de nuestro centro. Sin embargo, esto implica el traspaso de este alto costo al hospital y depende de la disponibilidad de horas de control en dicho policlínico. Esta distinta opción de manejo, abre la posibilidad de futuros estudios que comparen ambas opciones de tratamiento.
En relación a las limitaciones de este trabajo, podemos mencionar el escaso registro existente en algunas ocasiones, al tratarse de un estudio retrospectivo, y la posibilidad de una elección equivocada del diagnóstico usando la categorización CIE-10 disponible en la ficha electrónica. Destaca que en nuestra revisión no se encontró registro de ninguna complicación asociada al protocolo, sin embargo se tiene conocimiento de al menos 4 pacientes que cursaron con úlceras por presión en relación a la mantención de la via venosa en su domicilio, las cuales fueron pesquisadas en su control posterior en policlínico de pediatría. Como fortaleza cabe destacar que el estudio incluye la totalidad de los pacientes que recibieron esta forma de tratamiento en los años mencionados, contando con la información microbiológica de todos lo casos.
Conclusiones
El protocolo de tratamiento con amikacina es una guía de manejo actualizada y orientada a responder las necesidades de nuestra población objetivo. Asegura el control clínico oportuno y optimiza el manejo antibiótico, favoreciendo el manejo ambulatorio de estos pacientes.
Referencias
- Hevia J. P, Alarcón O. C, González C C, Nazal Ch V, Rosati M M. Recomendaciones sobre diagnóstico, manejo y estudio de la infección del tracto urinario en pediatría. Rama de Nefrología de la Sociedad Chilena de Pediatría. Parte 1. Rev Chil Pediatr. 2020;91(2): 281-288.
- Shaikh N, Morone NE, Bost JE, Farrell MH. Prevalence of urinary tract infection in childhood: A meta-analysis. Pediatr Infect Dis J. 2008;27(4):302-8.
- Lizama C. Macarena, Luco I. Matías, Reichhard T. Cristina, Hirrsch B. Tamara. Infección del tracto urinario en un servicio de urgencia pediátrico: Frecuencia y características clínicas. Rev. chil. infectol. 2005;22( 3 ): 235-241.
- Stein R, Dogan HS, Hoebeke P, Kočvara R, Nijman RJ, Radmayr C, Tekgül S; European Association of Urology; European Society for Pediatric Urology. Urinary tract infections in children: EAU/ESPU guidelines. Eur Urol. 2015 Mar;67(3):546-58.
- Poole NM, Kronman MP, Rutman L, Weissman SJ, Migita RT, Caglar D, Zerr DM. Improving Antibiotic Prescribing for Children With Urinary Tract Infection in Emergency and Urgent Care Settings. Pediatr Emerg Care. 2020 Jun;36(6):e332-e339.
- Logan LK, Braykov NP, Weinstein RA, Laxminarayan R; CDC Epicenters Prevention Program. Extended-Spectrum β-Lactamase-Producing and Third-Generation Cephalosporin-Resistant Enterobacteriaceae in Children: Trends in the United States, 1999-2011. J Pediatric Infect Dis Soc. 2014 Dec;3(4):320-8
- Siddiqi A, Khan DA, Khan FA, Razzaq A. Therapeutic drug monitoring of amikacin in preterm and term infants. Singapore Med J. 2009 May;50(5):486-9. PMID: 19495517.
- Peña D Anamaría, Viviani S Tamara, Le Corre P Nicole, Morales M Viera, Montecinos B Constanza, Gajardo S Cristina. Manejo de la infección del tracto urinario en lactantes febriles: Experiencia de tratamiento antimicrobiano intravenoso ambulatorio. Rev. chil. infectol. 2009; 26( 4 ): 350-354.
- Grupo de trabajo de la Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Guía de Práctica Clínica sobre Infección del Tracto Urinario en la Población Pediátrica. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Instituto Aragonés de Ciencias de la Salud. Guías Práctica Clínica en el SNS.2011;I+CN No2009/01.
- Somoes A, Oliveira E, Mak R. Urinary tract infection in pediatrics: an overview. Journal of pediatric (rio J), 2020; 96(S1):65-79
- National Collaborating Centre for Women's and Children's Health (UK). Urinary Tract Infection in Children: Diagnosis, Treatment and Long-term Management. London: RCOG Press; 2007 Aug. PMID: 21290637.
- Desai DJ, Gilbert B, McBride CA. Paediatric urinary tract infections: Diagnosis and treatment. Aust Fam Physician. 2016 Aug;45(8):558-63. PMID: 27610444.
- Robinson JL, Finlay JC, Lang ME, Bortolussi R; Canadian Paediatric Society, Infectious Diseases and Immunization Committee, Community Paediatrics Committee. Urinary tract infections in infants and children: Diagnosis and management. Paediatr Child Health. 2014 Jun;19(6):315-25.
- Ma J F, Shortliffe L M. Urinary tract infection in children: etiology and epidemiology. Urol Clin North Am 2004; 31: 517-26.
- Somoes A, Oliveira E, Mak R. Urinary tract infection in pediatrics: an overview. Journal of pediatric (rio J), 2020; 96(S1):65-79
- Cifuentes-D Marcela, Silva Francisco, García Patricia, Bello Helia, Briceno Isabel, Calvo-A Mario et al . Susceptibilidad antimicrobiana en Chile 2012. Rev. chil. infectol. 2014; 31( 2 ): 123-130.
- Zhu FH, Rodado MP, Asmar BI, Salimnia H, Thomas R, Abdel-Haq N. Risk factors for community acquired urinary tract infections caused by extended spectrum β-lactamase (ESBL) producing Escherichia coli in children: a case control study. Infect Dis (Lond). 2019 Nov-Dec;51(11-12):802-809.
- Tratselas A, Iosifidis E, Ioannidou M, et al. Outcome of urinary tract infections caused by extended spectrum (beta)-lactamase- producing Enterobacteriaceae in children. Pediatr Infect Dis J 2011; 30:707–10.
- Strohmeier Y, Hodson EM, Willis NS, Webster AC, Craig JC. Antibiotics for acute pyelonephritis in children. Cochrane Database Syst Rev [Internet]. 2014;(7).
|

