Introducción
La Infección Necrotizante de Tejidos Blandos (INTB) es una infección potencialmente mortal que evoluciona a la necrosis de tejidos blandos y puede comprometer la piel, tejido subcutáneo, fascia superficial y/o fascia profunda e incluso el músculo. La infección avanza rápidamente por el plano fascial, siendo en un comienzo, poco evidente externamente lo cual hace difícil su diagnóstico. La evolución de la INTB es rápidamente progresiva por lo que los pilares de su manejo es la alta sospecha diagnóstica y un tratamiento quirúrgico agresivo, dado su elevada letalidad.(1) La INTB ha acuñado varios términos en la literatura como fascitis necrotizante, gangrena hemolítica estreptocócica, gangrena gaseosa no clostridiana, celulitis crepitante no clostridiana, erisipela gangrenosa, infección por la batería asesina, celulitis de Meleney o necrotizante etc, pero actualmente el término Infección necrotizante de los tejidos blandos es la más aceptada.(2)
Existen cuatro tipos de INTB dependiendo de los microorganismos que generan la infección.(2) INTB Tipo I es una infección polimicrobiana producida por cocáceas gram negativas, gram positivas y anaerobios, es más frecuente en pacientes diabéticos o inmunodeprimidos. Cuando se presenta en la zona perineal, suele llamarse gangrena de Fournier. INTB Tipo II es una infección monomicrobiana donde el germen principal es el Estreptococos beta-hemolítico grupo A (S. Pyogenes) o el Estafilococo aureus, generalmente presentan una puerta de entrada cutánea y puede evolucionar a shock séptico, toxicidad sistémica y falla multiorgánica. Habitualmente se presenta en un paciente inmunocompetente. INTB tipo III es una infección causada por Clostridium sp, bacterias gram negativas o Vibrio sp, presentan una rápida progresión a falla multiorgánica y alta mortalidad. Las fascitis necrotizantes tipo IV son debidas a infecciones fúngicas en paciente inmunodeprimidos.
Los agentes patológicos que producen la enfermedad en la población adulta varían según los distintos centros de salud.(3–6) En Chile se describe que la presentación más frecuente es la INTB tipo I.(4,7) En la población pediátrica este tipo de infecciones necrotizante son frecuentemente producidas por Estreptococo Beta-hemolítico grupo A.(8)
Se debe sospechar INTB en pacientes que presenten una puerta de entrada cutánea, de aspecto infectada, que inicialmente puede impresionar como una celulitis. Luego el eritema en placa se extiende y se torna intensamente dolorosa asociado a aumento del calor local, induración de la piel, compromiso del estado general y fiebre mayor a 39ºC luego del tercer o cuarto día de evolución del cuadro(9). Se describen tres estadios de la evolución en la zona.(2,6,10) Primera etapa: existe infección que se extiende por la fascia, sin cambios evidentes en la superficie de la piel. En la segunda etapa, existen flictenas y bulas como signo de isquemia de la piel. En el estadio tres existen crépitos, anestesia local, y necrosis con un color grisáceo u opaco de la piel. Estos son signos tardíos pero patognomónicos de INTB. Un síntoma precoz que debe hacer sospechar de esta entidad es el dolor desproporcionado a la lesión observada.(5,11).
Luego del debridamiento quirúrgico todas las muestras deben ir a estudio histológico donde se describe infiltrado de polimorfonucleares en el tejido subcutáneo y fascia, con microabscesos y necrosis focal de la fascia superficial, trombosis y angeítis de arterias y venas fasciales y pueden existir baterías a la tinción de Gram a nivel de la fascia o dermis, sin compromiso de plano muscular.(7,12,13)
Se estima que la incidencia en Nueva Zelandia es de 0,18 – 1,7 por 100.000 niños y en Ontario, Canadá la incidencia de INTB por Estreptococo Beta-hemolítico grupo A es de 0,08 por 100.000 niños.(4,10) A nivel local existen reportes de casos pediátricos, pero no existen series de pacientes que describan el patrón epidemiológico de esta enfermedad en nuestra realidad en series más grandes.(14,15) El objetivo de este trabajo es describir del manejo perioperatorio de menores de 15 años que cursaron con esta patología durante 15 años en un Hospital pediátrico.
Pacientes y método
Se realizó un estudio de serie de pacientes que cursaron con INTB entre el 1º de enero de 2000 hasta el 31 de diciembre de 2015 en el Hospital de Niños Dr. Roberto del Río, encontrados a través de anatomía patológica. El Hospital de Niños Dr. Roberto del Río es un centro de atención terciario en Santiago de Chile, con una población pediátrica asignada de 175.000 niños, con 14 camas de UCI pediátrica, 21 camas de intermedio pediátrico, 8.000 hospitalizaciones al año y 105.000 atenciones de urgencias al año, aproximadamente.
Los criterios de inclusión de pacientes fue el diagnóstico confirmado a través del análisis de las muestras de anatomía patológica que describan: una inflamación aguda en todo el espesor del tejido, con zonas ulceradas, zonas necróticas, principalmente en fascia superficial y tejido celular subcutáneo y la identificación de colonias bacterianas. De la misma manera, se excluyeron los pacientes que no cumplan los criterios anátomo-patológicos para ser catalogados como INTB y pacientes mayores de 15 años.
De los pacientes seleccionados, se describieron las características demográficas, enfermedad de base o puerta de entrada, características clínicas de la lesión, antecedente de vacunación contra virus varicela zoster, tratamiento médico y quirúrgico realizado, horas desde la sospecha y desde el ingreso hasta el primer aseo quirúrgico, duración de la estada hospitalaria, complicaciones, microorganismo aislado, tiempo de seguimiento, manejo de secuelas y fallecimientos.
Se utilizó estadística descriptiva para el análisis de las variables en programa Stata 11.2
Este trabajo fue aceptado por el comité de ética de Hospital Dr. Roberto del Río y por el comité de ética del Servicio de Salud Metropolitana Norte.
Resultados
Se identificaron 22 pacientes, 15 hombres y 7 mujeres, con diagnóstico de INTB con una mediana de 2 años 9 meses de edad (rango intercuartil: 13 meses a 5 años y 10 meses). La principal etiología identificada fue la sobreinfección de lesiones de la varicela, en el 50% de los casos, e infección de herida operatoria de cirugía abdominal en 18% de los casos. Ningún paciente tiene el antecedente de haber sido vacunado contra virus varicella zoster. Todos los pacientes conscientes describieron intenso dolor en la zona, lo que impulsó la sospecha del diagnóstico. Todos presentan una herida inicial asociado a cambios inflamatorios locales como eritema y edema, principalmente. En 59% de los casos se describió exantema escarlatiniforme al examen físico durante la evolución de la enfermedad. 77% de los pacientes evolucionaron con inestabilidad hemodinámica, requiriendo el traslado a unidad de cuidados intensivo preoperatorio y el 33% restante fue trasladado a esa unidad después del primer procedimiento quirúrgico. En cuanto a las localizaciones, 64% de los casos se presentó en tronco y 32% en extremidades. Un paciente con infección del sitio de vacuna BCG fallece en la unidad de cuidados intensivo después de ser trasladado desde otro centro asistencial con historia de más de 48 horas de hiperestesia sin lograr entrar a pabellón. Al observar las fechas de presentación destaca que aunque esta complicación se puede presentar durante todo el año es más frecuente verano y otoño y menos frecuente en primavera. Ver Tabla 1.
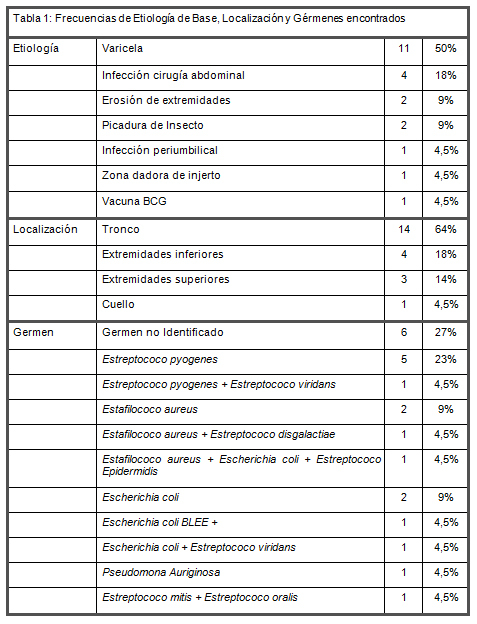
Se identificó microorganismos específicos en un 73% de los casos (ya sea en sangre o herida), catalogándose como INTB tipo I en 7 casos e INTB II en 9 casos. No hubo INTB tipo III ni IV. Los agentes identificados de mayor a menor frecuencia fueron: Estreptococos pyogenes (38% de los casos), Escherichia coli (31% de los casos) y Estafilococo Aureus (25% de los casos). Se identificó resistencia en un microorganismo, Escherichia coli BLEE (+). No hubo Estafilococo multirresistente. Se identificaron 2 pacientes con estado inmunológico alterado, uno presentó inmunodeficiencia asociada a la tratamiento quimioterápico por leucemia linfoblástica aguda y otro desnutrición en relación a obstrucción intestinal.
En relación con la prontitud de respuesta, se realizó aseo quirúrgico con una mediana de 13,5 días (rango intercuartil: 5 - 36 días) desde el ingreso, y una mediana de 6,8 horas (rango intercuartil: 4 - 19 horas) desde el inicio de la hiperestesia cutánea y 2 horas (rango intercuartil: 1,5 - 5 horas) desde la sospecha del diagnóstico.
Se realizaron aseos quirúrgicos en el 95% de los pacientes con necrosectomía de los segmentos comprometidos, aseo quirúrgico y desbridamiento, según la situación. El 100% de los pacientes requirió apoyo en unidad de cuidados intensivo pediátrico del hospital en el postoperatorio. Se realizaron repetidas intervenciones, con una mediana de 3 aseos quirúrgicos (rango intercuartil: 2 a 5) por paciente y se utilizó terapia aspirativa con presión negativa en 73% de los casos hasta lograr controlar la infección.
El esquema de tratamiento antibiótico más frecuentemente utilizado (72% de los casos) fue penicilina más clindamicina endovenosos, asociados o no a un anti-estafilococo según el estudio microbiológico, con una mediana de tiempo de 11 días (rango intercuartil: 10 – 14 días) de tratamiento en total.
Se realizó cierre primario o terciario del defecto en 30% de los casos (todos con INTB por varicela), injertos dermoepidérmicos mallados o laminares en 30% de los casos y colgajos con o sin injertos en 40% de los casos restantes. Se utilizaron matrices dérmicas (Integra®) en 2 pacientes durante el cierre de la herida. Se observaron pérdidas parciales de los injertos en 3 pacientes dado infección de estos, que requirieron injertos complementarios. En uno de estos pacientes se había instalado una matriz dérmica. En un paciente no se logró el cierre de la herida dado que falleció secundario a fasceitis necrotizante de la pared abdominal, como complicación de una invaginación intestinal.
El promedio de días de hospitalización tuvo una mediana de 11 días (rango intercuartil: 10 – 19 días). De los 20 niños sobrevivientes, 14 no presentaron secuelas y sólo 6 presentaron cicatrices inestéticas con o sin alteración funcional, siendo uno de ellos asociado a linfedema de la extremidad inferior. Se manejaron con kinesiología compresiva de las cicatrices en 3 pacientes, resección de la cicatriz y cierre primario en 1 paciente, instalación de expansores tisulares y avance de colgajos en 1 paciente y resección de cicatriz e instalación de matriz dérmica Integra® e injerto dermoepidémico posterior en 1 paciente. No se observaron complicaciones del manejo quirúrgico de las secuelas. En forma ambulatoria 11 pacientes se estudió el estado inmunitario de los pacientes, sin encontrar hallazgos significativos.
Discusión
Se describió una serie de casos de pacientes menores de 15 años con el diagnóstico de INTB, en donde se detalla la presentación clínica y el manejo quirúrgico de estos pacientes. En la mayoría se identificó a INTB tipo 2 producto a la sobreinfección cutánea en un paciente que cursa con varicela. La localización más frecuente fue el tronco y luego las extremidades. La segunda patología de base más frecuente fue la infección de la herida en relación a cirugía abdominal. Esta presentación difiere de los reportes de INTB en pacientes adultos y de los casos pediátricos reportados en países que incorporaron la vacuna contra el virus varicela zoster. En pacientes adultos la INTB se localiza, más frecuentemente, en la zona perianal, genital y extremidades, y son pacientes con comorbilidades como hipertensión arterial, diabetes, obesidad, insuficiencia hepática, etc., siendo la INTB polimicrobiana (tipo I) la más frecuente.(6,16) En la mayoría de los casos pediátricos corresponden a pacientes inmunocompetentes y sin comorbilidades, como se describe en esta serie(8).
En los países con cobertura de vacuna contra el virus varicela zoster la primera causa INTB es secundaria a trauma en extremidades.(8,10,17) En otros países se ha observado un alza de la incidencia de INTB en pacientes pediátricos posiblemente por el aumento de tratamientos quimioterápicos y un mayor uso de trasplante de médula ósea(18). En nuestra serie solo un caso fue identificado con este factor de riesgo. Con los cambios epidemiológicos de la población pediátrica en Chile, probablemente aumentará la presentación de INTB en relación a tratamiento contra el cáncer infantil en los próximos años.
Los pacientes de esta serie tienen una mediana de edad de menos de 5 años, al igual que otras publicaciones de países sin vacuna contra el virus varicela zoster.(8,10) Al igual que esta serie otras publicaciones identifican a los varones menores de edad como al grupo más frecuentemente afectado, sin un claro motivo que explique esta distribución.(10,17)
Destacamos en relación a los signos locales de la herida, todos los paciente conscientes referían intenso dolor a la palpación superficial y profunda en la zona con eritema. Este signo es el que debe hace sospechar al tratante que está frente a INTB y no frente a una celulitis habitual. No identificarlo pude permitir que la enfermedad progrese y llevar a rápido compromiso hemodinámico. Las bulas hemorrágicas, enfisema subcutáneo y franca necrosis son signos tardíos con los cuales aumenta la mortalidad. En más del 70% de los casos de esta serie requirió traslado a UCI frente a la sospecha clínica y/o alteración hemodinámica concomitante. Una vez que el paciente presenta compromiso de conciencia la sospecha clínica debe mantenerse y platearse la necesidad exploración quirúrgica y eventual debridamiento según hallazgos.
Las imágenes tienen un uso limitado en esta patología. Imágenes que muestren aire en el tejido subcutáneo, líquido entre los planos, engrosamiento de la fascia pueden ser sugerente de INTB, pero tienen baja sensibilidad y especificidad.(2,5) Las imágenes tendrían mayor utilidad en casos de infecciones profundas como abscesos y osteomielitis.(10) La resonancia magnética permite hacer la diferenciación con otras infecciones que no requieren exploración pero su limitación es el tiempo y la sedación que se necesita en la edad pediátrica.(10) En esta serie de casos la mayoría de los pacientes no se les realizó imágenes, dado que frente a la sospecha clínica de esta patología pueden retrasar la conducta quirúrgica.
Algunos autores plantean otras formas para aumentar la probabilidad pretest de estar frente a un paciente con INTB. La modificación del score LRINEC a la población pediátrica (P-LRINEC) incluye niveles de proteína C reactiva > 20 mg/L (sensibilidad 95%) y niveles de sodio plasmático < 135 mEq/L (especificidad 95%) los cuales tienen mayor poder predictivo de INTB en niños y permite diferenciarla de celulitis en esta población.(19) Otro examen de laboratorio que podría ayudar en esta diferenciación es el alza de creatinin kinasa.(20) Dado que estos exámenes no fueron realizados en la gran mayoría de los casos en esta serie no se describe estos resultados.
Los pilares del tratamiento son la exploración quirúrgica precoz y los antibióticos endovenosos. Todo paciente con sospecha debe explorarse en pabellón con el objetivo de desbridar y resecar toda la fascia comprometida.(2) Al explorar al paciente en pabellón se encuentra un tejido subcutáneo grisáceo que se separa fácilmente de la fascia superficial a la disección digital.(6) Toma cultivos de tejido, cultivo de secreción, hemocultivos en sangre y/o PCR de bacterias son de rigor en estos casos. Wong et al. platea que existen tres áreas en la piel con INTB: zona 1 con necrosis franca; zona 2 donde la piel presenta eritema, edema y dolor; y zona 3 donde la piel es de aspecto normal. Habitualmente se plantea un abordaje en donde se extienda una incisión hasta la zona 3, y resecar hasta que se observe sangrado normal.(21). Recientemente se han planteado resecciones con ahorro de piel, en donde se reseca la fascia y subcutáneo alterados con una circunferencia más amplia que la resección externa de la piel. Se pudiese plantear este manejo cuando existe la posibilidad de analizar los bordes quirúrgicos resecados con biopsia rápida, entregando la tranquilidad de no dejar tejido afectado en la primera cirugía.(10) Esto tal vez no sea recomendable si no se cuenta disponible la biopsia rápida. Posteriormente, se debe planificar la cantidad de aseos que sean necesarios, siendo el segundo aseo idealmente a las 24 a 48 hrs.(10)
La prontitud de respuesta es fundamental para disminuir los casos de fallecimientos. Los dos casos asociadas a muertes en esta serie tienen relación con un debridamiento incompleto y falta de sospecha de la patología. Nuestra serie muestra una respuesta quirúrgica precoz frente a la sospecha, de tan solo 2 horas, por los equipos de urgencia del hospital. Esto refleja un conocimiento adecuado de la patología y un enfoque quirúrgico de las necesidades de los niños. Llama la atención que estos pacientes tienen una estadía hospitalaria de días antes de la primera intervención por INTB. Esto se explica porque la patología inicial en sí ya requiere hospitalización para luego evolucionar con INTB, aspecto importante que se debe tener presente para generar la sospecha de una infección profunda.
El esquema de antibioterapia más adecuado debe incluir betalactámicos asociados a clinidamicina, teniendo este último antibiótico un efecto específico en la disminución de la producción de toxinas del Estreptococos beta-hemolítico grupo A.(10) En esta serie de casos ese fue el esquema utilizado, excepto los casos asociados a cirugía abdominal. En esta serie no encontramos Estafilococos aureus meticilino resistente como causante de INTB. A pesar de que existen casos en la población hospitalaria de este agente, no está recomendada la cobertura empírica contra este microorganismo, a no ser que se identifique este en los cultivos.(12,20,21)
Una vez debridado el defecto se puede cubrir con curación avanzada o curación por presión negativa.(10,15,21) No se debe utilizar esta última opción en caso de infección por anaerobios, necrosis o pus, por lo que, idealmente, se debe tener el resultado del cultivo negativo antes de instalar este tipo de curación.(2) Por este motivo en esta serie no todas los pacientes se cubrieron con curación a presión negativa, pero ha sido una herramienta cada vez más incorporada en el uso clínico en lo largo del tiempo.
La probabilidad de fallecer de INTB es del 10% en la edad pediátrica(8) y 20-40% en adultos, con un riesgo de amputación de 8-15%.(2) La letalidad se asocia a la falta de sospecha de la enfermedad y el subsecuente inicio tardío del tratamiento, como sucedió en algunos de los pacientes analizados.(6,17,24) Por cada hora que pasa aumentan los fallecidos; una demora de más de 24 horas entre el inicio de los síntomas y el desbridamiento se ha identificado como un factor de riesgo de morir tanto en adultos y niños.(2,6,17) En niños otros factores de riesgo asociados destacan principalmente comorbilidades oncológicas.(8) Algunas fuentes sugieren que las INTB causadas por agentes del tipo I tendrían una evolución más rápidamente progresiva en comparación con las tipo II.(25)
La latencia entre la primera agresión cutánea y el inicio de los síntomas de INTB depende del tipo de puerta de entrada. Por ejemplo, en el caso de INTB postapendicectomía, el tiempo desde la resección del apéndice hasta el diagnóstico de INTB fue de 5,4 días pero en el caso de los niños con varicela eso se prolonga hasta 2 semanas.(7,9,20)
El factor de riesgo más importante en la población pediátrica para el desarrollo de INTB y de otras enfermedades invasivas producidas por Estreptococo beta-hemolítico grupo A es la varicela.(8,9,26) La vacunación contra varicela podría disminuir 10-15% de la enfermedades invasivas producidas por Estreptococo beta-hemolítico grupo A y la mayoría de los casos de INTB.(8,27) En Chile el programa de vacunación nacional no incluye esta vacuna y solo acceden a esta vacuna los padres que pueden costearla.(28) En países como Estados Unidos que sí aplican esta estrategia, se ve una disminución de hospitalizaciones por varicela en pacientes pediátricos, en un 75% en niños menores de 9 años, al igual que una disminución en las infecciones graves por Estreptococos sp. en pacientes cursando con varicela(9).
Una de las limitaciones de este estudio es el número relativamente pequeño de pacientes. Sin embargo, dado la baja incidencia de la INTB, esta serie de pacientes puede considerarse representativa de la presentación clínica de esta enfermedad. Otra limitación del estudio es el carácter retrospectivo de la recolección de los datos ya que no permite identificar variables no detalladas en los registros ya hechos, por ejemplo, indagar más en el papel que jugó la INTB en el fallecimiento de los pacientes o indagar en el estado inmunológico previo de los pacientes. Otra limitación identificada, es la falta de estudio de la inmunidad de los pacientes de a serie, ya que de esta manera se podría encontrar una correlación entre el estado inmunológico basal y la evolución del cuadro.
Conclusiones
La infección necrotizante de tejidos blandos (INTB), como hemos visto, es causal de grandes procesos infecciosos que pueden causar hasta la muerte. La letalidad se asocia a la falta de sospecha de la enfermedad y el subsecuente inicio tardío del tratamiento. El uso del P-LRINEC y la creatininkinasa son herramientas de utilidad para aumentar la probabilidad pretest de estar frente a un cuadro de INTB, ya que en ciertos casos puede ser difícil llegar al diagnóstico clínicamente. Una vez diagnosticado, es fundamental para determinar la evolución del cuadro, iniciar un tratamiento precoz con desbridamiento quirúrgico y antibioterapia endovenosa bi o triasociada, además de la realización de cultivos para el ajuste del tratamiento. Además, es fundamental el envío de muestras a estudio histopatológico.
En los pacientes pediátricos que se evaluaron en esta serie, nos percatamos de que una de las principales enfermedades de base es la infección de las lesiones propias de la varicela y que el factor de riesgo de letalidad más importante es el tratamiento tardío. Existe un patrón distinto de presentación en la población adulta y en los países que tienen implementada la vacunación contra la varicela. Tal vez, la implementación de la vacuna contra la varicela en la infancia en el Plan Nacional de Inmunizaciones de Chile pudiese disminuir la frecuencia de presentación de la INTB.
Referencias
- Wang JM, Lim HM. Necrotizing fasciitis : eight-year experience and literature review. Brazilian J Infect Dis,2014;18(2):137–143.
- Leiblein M, Marzi I, Sander AL, Barker JH, Ebert F, Frank J. Necrotizing fasciitis: treatment concepts and clinical results. Eur J Trauma Emerg Surg,2018;44(2):2179-290.
- Andriescu L, Dănilă R, Bădic B, Rădulescu C, Dragomir C, Tamaş C, et al. Necrotizing fasciitis. Chirurgia,2005;100(4):391–3.
- Cardenas P, Ríos M, E Troncoso, Cárdenas T. Faceitis Necrotizante durante los últimos años en el Servicio de Cirugía del hospital Salvador. Rev, Medicina y Humanidades,2009;1(3):39-47.
- Harbrecht BG, Nash NA. Necrotizing Soft Tissue Infections: A Review. Surg Infect,2016;17(5):503-9.
- Liu YM, Chi C-Y, Ho MW, Chen CM, Liao WC, Ho CM, Lin PC, Wang JH. Microbiology and factors affecting mortality in necrotizing fasciitis. J Microbiol Immunol Infect,2005;38(6):430–5.
- Pacheco A, Bravo I, Condemarín J, Peñaloza S, Gálvez J, Palacios R. Fascitis necrotizante post-apendicectomía. Rev Chil Cir,2004;56(1):35-39.
- Laupland KB, Davies HD, Low DE, Schwartz B, Green K, McGeer A. Invasive group A streptococcal disease in children and association with varicella-zoster virus infection. Ontario Group A Streptococcal Study Group. Pediatrics, 2000;105(5):E60.
- Prego J, Sehabieague G, De Leonardis D, Gutierrez C. Varicela complicada con fascitis necrotizante. Importancia de un diagnóstico oportuno. Arch Pediatr Urug,2001;72(1):S85–88.
- Rüfenacht MS, Montaruli E, Chappuis E, Posfay-Barbe KM, La Scala GC. Skin-Sparing Débridement for Necrotizing Fasciitis in Children. Plast Reconstr Surg,2016;138(3):489e–497e.
- Moyano M, Peuchot A, Giachetti AC, Moreno R, Cancelara A, Falaschi A, Chiarelli G, Villasboas R, Corazza R, Magneres C, Calvari M, Roldan D. Infecciones de piel y partes blandas en pediatría: consenso sobre diagnóstico y tratamiento. Arch Argent Pediatr,2014;112(2):e96-e102.
- Martínez MJ. Infecciones virales y exantemas no tradicionales. Rev. chil. pediatr,2005;76(5):521-527. 19.
- Kosloske AM, Cushing AH, Borden TA, Woodside JR, Klein MD, Kulasinghe HP, Bailey WC. Cellulitis and necrotizing fasciitis of the abdominal wall in pediatric patients. J Pediatr Surg,1981;16(3):246–51.
- Bustos R, Soto G, Hickmann L, Torres C. Fascitis necrosante palpebral y shock toxico por S. pyogenes. Rev Chil Infectología,2009;26(2):152–155.
- Turenne D, Villegas S, Claure P, Yañez J, Cabellero B. Fascitus Necrotizante Tratada con Sistema de Aspiración Negativa (VAC®): Casos Clínicos. Rev. Ped. Elec,2009;6(3):267.
- VanderMeulen H, Pernica JM, Roy M, Kam AJ. A 10-Year Review of Necrotizing Fasciitis in the Pediatric Population: Delays to Diagnosis and Management. Clin Pediatr,2016;56(7):627-633.
- Levett D, Bennett M, Millar I. Adjunctive hyperbaric oxygen for necrotizing fasciitis. Cochrane Database of Systematic Reviews,2015,Jan(1):CD007937.
- Murphy JJ, Granger R, Blair GK, Miller GG, Fraser GC, Magee JF. Necrotizing Fasciitis in Childhood. J Pediatr Surg,1995;30(8):1131–4.
- Bechar J, Sepehripour S, Hardwicke J, Filobbos G. Laboratory risk indicator for necrotising fasciitis (LRINEC) score for the assessment of early necrotising fasciitis: A systematic review of the literature. Ann R Coll Surg Engl,2017;99(5):341–346.
- Putnam LR, Richards MK, Sandvall BK, Hopper RA, Waldhausen JH, Harting MT. Laboratory evaluation for pediatric patients with suspected necrotizing soft tissue infections: A case-control study. J Pediatr Surg,2016;51(6):1022–5.
- Wong Ch, Yam AK, Tabn AB, Song C. Approach to debridement in necrotizing fasciitis. Am J Surg,2008;196(3):e19–24.
- Stacey DH, Fox BC, Poore SO, Bentz ML, Gutowski KA. Community-acquired methicillin-resistant staphylococcus aureus: diagnosis and treatment update for plastic surgeons. Plast Reconstr Surg,2008;122(4):120e–7e.
- Acuña M, Benadof D, Jadue C, Hormazábal JC, Alarcón P, Contreras J, Torres R, Mülchi C, Aguayo C, Fernández J, Araya P. Community associated-methicillin-resistant Staphylococcus aureus (SAMR-AC):comunication of the first four paediatric cases in the Roberto del Río Children`s Hopsital. Rev Chil Infectol,2015;32(3):350–6.
- Mao JC, Carron MA, Fountain KR, Stachler RJ, Yoo GH, Mathog RH, Coticchia JM. Craniocervical necrotizing fasciitis with and without thoracic extension: management strategies and outcome. Am J Otolaryngol;2009;30(1):17–23.
- Irwin K, English William. The Diagnosis and Management of Necrotising Fasciitis. ATOTW298,2013;Nov(11):1–7.
- Toledo C. Varicela complicada con fascitis necrotizante. Reporte de un caso. Cirugía Plástica,2000;10(2):72–3.
- Pinochet C, Cerda J, Hirsh T, Mieres J, Inostroza C, Abarca K. Effecriveness of varicella vaccine as post exposure prophilaxis in Chilean children. Rev Chil Infectol, 2012;29(6):635-40.
- Hunt N, García C, Acuña M. Revisión bibliográfica: Varicela. Revista Pediatría Electrónica, 2013;10(3): 4-12. ISSN 0718-0918.
|

