El coronavirus es un patógeno que han tenido brotes previos que incluyen el síndrome respiratorio agudo severo (SARS)-CoV y el Síndrome respiratorio del Medio Oriente (MERS) -CoV, los cuales han sido amenaza para la salud pública. A fines de diciembre de 2019, un grupo de pacientes ingresaron en varios centros hospitalarios con un diagnóstico inicial de neumonía de etiología desconocida. Estos pacientes estaban epidemiológicamente vinculados a un mercado mayorista en Wuhan, provincia de Hubei, China. Para enero 2 del presente año, 41 pacientes hospitalizados ingresados habían sido identificados como con infección por COVID-19 confirmada por laboratorio, El 7 de enero de 2020, la Organización Mundial de la Salud (OMS) lo nombró como el nuevo coronavirus 2019 (es decir, 2019-nCoV). El 11 de febrero de 2020, la OMS nombró la enfermedad asociada con 2019-nCoV como la enfermedad por coronavirus 2019 (COVID-19). (1-2-3)
A pesar de la propagación mundial, los patrones epidemiológicos y clínicos del COVID-19 siguen siendo poco claros, particularmente entre los niños. Aunque las series de casos reportadas hasta ahora han mostrado que la mayoría de los pacientes pediátricos tienen buen pronóstico y en casos leves se recuperan entre 1-2 semanas se debe tener en cuenta que en los últimos reportes se conocen fallecimientos de pacientes pediátricos cada vez de menor edad, incluso sin comorbilidades previas. (4-5)
Método
Revisión de literatura actual confrontando con artículos de revisiones de temas en búsqueda electrónica en bases de datos de RIMA, MEDLINE, PUB-MED, MEDSCAPE, de 2019-2020
Resultados
Epidemiologia
La principal fuente de infección son los pacientes infectados por SARS-CoV2. La transmisión en periodo de incubación por personas asintomáticas ha sido descrita. Se transmite a través de las gotas respiratorias (> 5 micras) cuando los pacientes tosen, hablan o estornudan. El contacto cercano también es una fuente de transmisión (por ejemplo, contacto con la boca, nariz o conjuntiva ocular a través de las manos contaminada). La transmisión vertical no está documentada, pero se ha detectado un recién nacido de una madre infectada que ha sido positivo para el virus a las 30 h de vida. Se desconoce la posible transmisión a través de la leche materna. Los casos pediátricos documentados son menos frecuentes que en adultos y de carácter más leve, aunque todo el espectro de gravedad parece posible. (1)
En el momento de preparando este manuscrito, la Organización Mundial de la Salud (OMS) informó a nivel mundial, el número de casos confirmados (17 junio de 2020) de 8.269.774 casos confirmados en 185 países, con 445.762 muertes siendo los países con mayor número de muertes; Brasil, Reino unido, Italia, Francia, y Españas, para Colombia cuenta con 54.931 casos confirmados y 1.801 muertes según el instituto nacional de salud. (2-4,5)
Transmisión
Basado en la gran cantidad de personas infectadas que estuvieron expuestas a el mercado de animales silvestres en la ciudad de Wuhan donde los animales vivos son habitualmente comercializados, se sugiere que este es probablemente el origen zoonótico del COVID- 19. Se han realizado esfuerzos para buscar un reservorio, huésped o portadores intermedios por los cuales la infección pudo haberse propagado a los humanos. Hasta la fecha, no hay evidencia de reservorios de coronavirus que no sean mamíferos y aves, tal como se muestra en la Figura 1. El análisis de secuencia genómica de COVID-19 mostró 88% identidad con dos síndromes respiratorio agudo severo derivado de murciélagos (SARS), lo que puede indicar su vínculo más probable entre COVID-19 y los humanos, y posterior transmisión de persona a persona la cual es la causal de la pandemia actual (4-5-6-7)
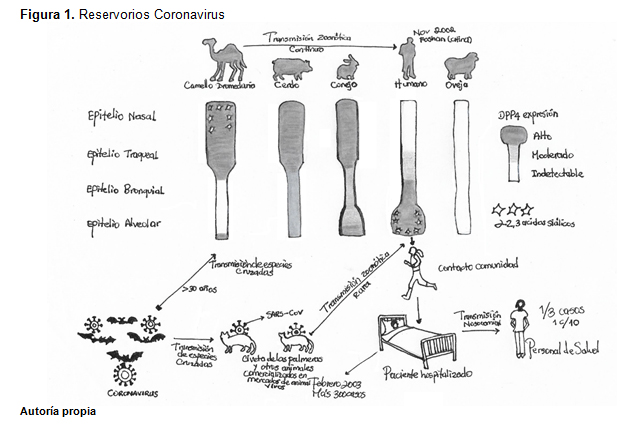
El periodo de incubación asintomática se estimó para variar de 1 a 14 días (probablemente 3 a 10 días). Aunque en un principio no se tenía claro si en los pacientes asintomáticos tenían títulos virales suficientemente altos para propagar el virus, existe evidencia de que los pacientes asintomáticos son propagadores del virus. Una cantidad muy importante asociada con el virus en la transmisibilidad es el número de reproducción básico que generalmente es denotado por R0 (pronunciado "R nada"). La definición epidemiológica de R0 es el número promedio de personas que obtendrán la enfermedad de una persona contagiada y se aplica específicamente a una población de personas que previamente estaban libres de infección y no vacunados. Existen tres posibilidades para la propagación potencial o disminución de una enfermedad, dependiendo de su valor R0: 1 es decir si R0 es menor que 1, cada infección existente causa menos de 1 nueva infección. En este caso, la enfermedad disminuirá y eventualmente desaparecerá. Si R0 es igual a 1, la enfermedad se mantendrá latente, pero no habrá epidemia. En cambio, si R0 es mayor que 1, los casos podrían crecer exponencialmente y causar una epidemia o incluso una pandemia. Por lo que sabemos actualmente, el valor R0 calculado para 2019-nCoV es significativamente mayor que 1. (2-7-8)
En contraste estudios previo sugieren que el R0 para MERS-CoV es menor que 1, lo que significa que es poco probable que cause una pandemia. Con el 2019-nCoV se tiene una situación de super dispersión, super propagación y super diseminación, con un R0 mayor de 10 relacionándose con la pandemia que enfrentamos actualmente ya que hasta el 10% de los pacientes pueden asociarse a super diseminación lo cual impide un rápido control en la propagación del virus. (2-8-9)
Relación entre patogenicidad viral y transmisibilidad:
La gravedad de la enfermedad suele ser un factor indirecto importante en la capacidad de propagación de un virus. Debido a que los coronavirus tienen tendencia al ARN polimerasas, mutaciones y eventos de recombinación ocurren con frecuencia, resaltando en cuasi especies con mayor diversidad, estrechamente asociado con la evolución adaptativa y la capacidad de causar enfermedades. Notablemente ACE2 (enzima convertidora de angiotensina 2), la proteína receptora de SARS-CoV y 2019-nCoV, esta abundantemente presente en epitelios pulmonares e intestinal humano, lo que se relaciona con síntomas respiratorios superiores y del tracto gastrointestinal. (4-9-11-12)
Fisiopatología
Análisis filogenético
La Organización Mundial de la Salud (OMS) ha clasificado COVID-19 como un β CoV del grupo 2B. La secuencia genética mostró más del 80% de identidad con el SARS-CoV y el 50% con el MERSCoV, tanto el SARS-CoV como el MERS-CoV se originan en los murciélagos lo cual es muy relevante. (6-12)
La evidencia del análisis filogenético indica que pertenece al género betacoronavirus, que incluye SARSCoV que infecta a humanos, murciélagos y animales salvajes. Representando el séptimo miembro de la familia de los coronavirus que infecta a los humanos siendo clasificado como subfamilia ortocoronavirinas dentro del subgénero sarbecovirus, siendo un virus de ARN monocatenario, Figura 2. (6-7-12)
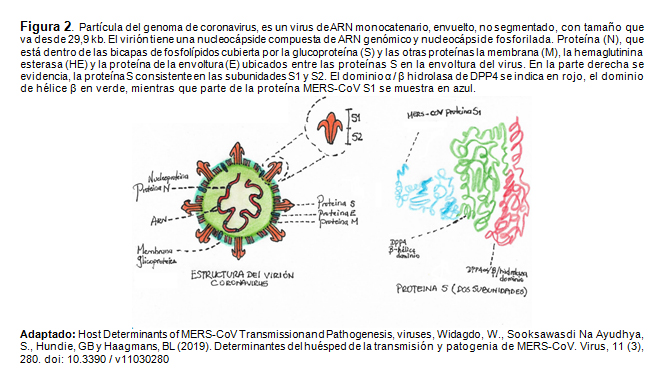
Interacciones Receptor y Entrada Celular
La enzima convertidora de angiotensina humana 2 (ACE2) es un receptor funcional secuestrado por SARS-CoV-2 para la entrada celular, similar al SARS-CoV. ACE2 es una proteína de membrana tipo I expresada en pulmón, corazón, riñón e intestino principalmente asociados con enfermedades cardiovasculares. El ACE2 de cuerpo entero consiste en un dominio de peptidasa N-terminal (PD) y un dominio similar a Collectrin (CLD) C terminal que termina con una sola hélice transmembrana y un segmento intracelular de 40 residuos. Adicionalmente para la escisión de angiotensina (Ang) I para producir Ang, ACE2 también proporciona un sitio de unión directa para las proteínas S de CoVs. La proteína S de CoV existe en una conformación de prefusión estable que sufre un reordenamiento estructural dramático para fusionar la membrana viral con la célula huésped membrana. Este proceso se desencadena por la subunidad S1 y la unión del receptor de la célula huésped, que desestabiliza el trímero de pre-fusión, lo que resulta en el desprendimiento de la subunidad S1 y la transición de la subunidad S2 a una conformación post-fusión altamente estable. Para comprometer un receptor de células huésped, la unión al receptor del dominio de S1 sufre movimientos conformacionales tipo bisagra que se esconden o exponen transitoriamente determinando la unión al receptor. Para descubrir el potencial del SARS-CoV-2 para infectar a los humanos el dominio de unión al receptor de su proteína S está en contacto con ACE2, sugiriendo que la proteína S del SARS-CoV-2 probablemente se une al ACE2 humano con una capacidad 10-20 veces mayor que el SARS-CoV. (7-8-12-13).
Patogénesis
El SARS-CoV-2 se transmite predominantemente a través de gotitas respiratorias, contacto y potencialmente vía fecal-oral. Se presume que la replicación viral primaria ocurre en el epitelio de la mucosa de la parte superior tracto respiratorio (cavidad nasal y faringe), con multiplicación adicional en el tracto respiratorio inferior y mucosa gastrointestinal, dando lugar a una viremia leve. Pocas infecciones se controlan permaneciendo asintomáticos. Algunos pacientes también han presentado síntomas no respiratorios, como daño hepático y cardíaco agudo, insuficiencia renal, diarrea, lo que implica la afectación de múltiples órganos. ACE2 se expresa ampliamente en la mucosa nasal, bronquios, pulmones, corazón, esófago, riñón, estómago, vejiga e íleon, y estos órganos humanos son todos vulnerables al SARS-CoV-2, lo que se podría relacionar con su afectación multiorgánica. Recientemente, se ha propuesto la patogenicidad del SARS-CoV-2 en tejidos testiculares, lo que implica problemas de fertilidad en pacientes jóvenes. Los síntomas graves de COVID-19 están asociados con un aumento números y tasa de muertes especialmente en la región epidémica de China. Los pacientes infectados con COVID-19 mostraron un mayor número de leucocitos, hallazgos respiratorios anormales y aumento de los niveles citoquinas proinflamatorias en plasma. (6-8)
Los estudios de laboratorio mostraron leucopenia con recuentos de leucocitos de 2.91 × 10 ^ 9 células / L de los cuales el 70,0% eran neutrófilos. Además, se observaron aumentos en la proteína C reactiva, en la velocidad de sedimentación globular y dímero D. La patogenia principal de la infección por COVID-19 afecta el sistema respiratorio relacionándose con el desarrollo de neumonía severa, con aparición de opacidades en vidrio esmerilado y lesión cardíaca aguda. Niveles sanguíneos significativamente altos de citocinas y quimiocinas se observan en pacientes con infección por COVID-19 incluyendo IL1-β, IL1RA, IL7, IL8, IL9, IL10, FGF2 básico, GCSF, GMCSF, IFNγ, IP10, MCP1, MIP1α, MIP1β, PDGFB, TNFα y VEGFA. Algunos de los casos severos que ingresaron a la unidad de cuidados intensivos mostraron altos niveles de citocinas proinflamatorias que incluyen IL2, IL7, IL10, GCSF, IP10, MCP1, MIP1α y TNFα que se activan y se relacionan con la gravedad de la enfermedad. (6-8-11)
En la patogenicidad de 2019-nCoV en las primeras infecciones confirmadas por laboratorio, todos tenían neumonía viral y casi un tercio de los pacientes desarrollo síndrome de dificultad respiratoria aguda (SDRA) este es una afección pulmonar potencialmente mortal que impide que llegue suficiente oxígeno a los pulmones y hacia la circulación aumentando los trastornos respiratorios y lesión pulmonar aguda. En casos fatales de infecciones humanas por SARS-CoV, MERS-CoV y SARS-CoV-2, los individuos presentan dificultad respiratoria severa que requiere ventilación mecánica. Estudios han encontrado que la susceptibilidad genética y la respuesta inflamatoria por citocinas están estrechamente relacionadas con la aparición de SDRA. Más de 40 genes incluidos ACE2, interleucina 10 (IL-10), factor de necrosis tumoral (TNF) y factor de crecimiento endotelial vascular (VEGF), entre otros, se han considerado asociados con el desarrollo o el resultado de SDRA, como se muestra en la Figura 3. También se demostró que los niveles elevados de IL-6 e IL-8 en plasma están relacionados con efectos adversos en el resultado de SDRA. Los biomarcadores anteriores sugieren una explicación molecular el SDRA severo y un posible tratamiento para SDRA después de la infección por SARS-CoV-2. (7-12)
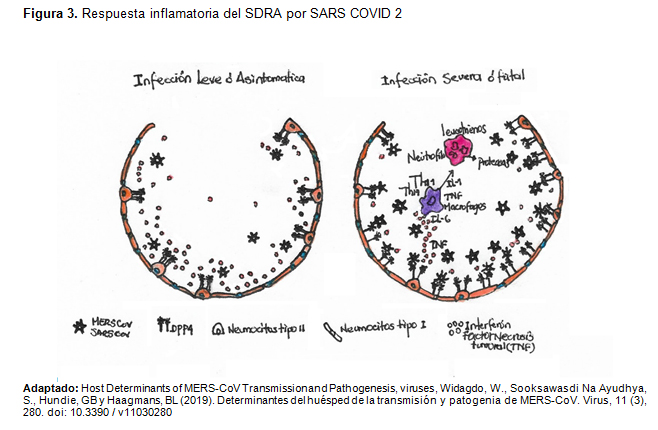
Tormenta de citoquinas y disfunción inmune
Los hallazgos clínicos mostraron respuestas inflamatorias exageradas durante la infección por SARS-CoV-2, resultando además en inflamación pulmonar no controlada, probablemente una de las principales causas de letalidad. Se ha demostrado que el SARS-CoV-2 secuestra lo receptores de entrada ACE2. El inicio de la replicación viral rápida puede causar una masiva muerte celular epitelial y endotelial y fuga vascular, desencadenando la producción exagerada de citocinas y quimiocinas proinflamatorias. La pérdida de la función pulmonar de ACE2 ha sido relacionado con la lesión pulmonar aguda como se mencionó anteriormente esto por una regulación negativa y la eliminación de ACE2 provocando una disfunción del sistema renina-angiotensina (SRA) aumentando más la inflamación causando permeabilidad vascular favoreciendo el SARS-CoV. (7-12-12-13)
Las células T periféricas CD4 y CD8 mostraron reducción e hiperactivación en pacientes grave. Las altas concentraciones de células T CD4 proinflamatorias y los gránulos citotóxicos también fueron células T CD8 determinados, lo que sugiere respuestas inmunitarias antiviral y sobre activación de células T. Adicionalmente, Varios estudios han informado que la linfopenia es una característica común de COVID-19, lo que sugiere un factor crítico que explica la gravedad y la mortalidad. (7)
Clínica
La experiencia acumulada con la pandemia asociada al COVID-19, indica claramente que en los diferentes países el porcentaje de niños afectados por lo regular no sobrepasa el 20 % del total de pacientes. Con base en los datos epidemiológicos actuales, el período de incubación de las infecciones de COVID-19 varía de 1 a 14 días, en su mayoría de 3 a 7 días. Los datos de notificación actuales de casos pediátricos revelaron que la edad de inicio de la enfermedad osciló entre 1,5 meses y 17 años, la mayoría de los cuales tenían un contacto cercano con casos infectados o eran casos de agrupación familiar. El espectro clínico de los niños infectados es absolutamente variable, muchos de estos pequeños pacientes pueden cursar completamente asintomáticos o presentar fiebre, tos seca y/o fatiga, otros pueden tener síntomas respiratorios superiores, como congestión nasal y rinorrea clara. Algunos presentaron síntomas gastrointestinales como malestar abdominal inespecífico, náuseas, vómitos, dolor abdominal y diarrea de características variables. Otro grupo de niños y recién nacidos presentan síntomas atípicos, que se manifiestan como vómitos, diarrea y otros síntomas gastrointestinales. En los más comprometidos con frecuencia se detectan hallazgos típicos de bronco obstrucción o compromiso pulmonar parenquimatoso. El desaliento es evidente en la mayoría de estos casos (15).
El primer caso grave de infección infantil reportado en Wuhan, China, comenzó con síntomas gastrointestinales, no mostró manifestaciones respiratorias tempranas. La duración de la fiebre fue principalmente de 1 a 2 días y la más larga fue de 8 días. La mayoría de los exámenes de sangre de rutina fueron normales y las concentraciones de proteína c reactiva (PCR) fueron normales o aumentaron de manera transitoria. De los 54 pacientes con datos de imágenes pulmonares, 38 (70,4%) presentaron opacidades o exudados en vidrio esmerilado, lesiones infiltrativas; 4 (7,4%) mostraron una mejor textura pulmonar; y 12 (22,2%) no presentaron anomalías. (16-17-18)
Los datos muestran que la prevalencia de la enfermedad en niños después de los 18 años es relativamente baja, representando aproximadamente 2,4%, y las características clínicas de los casos adultos (síntomas graves, tiempo de desintoxicación prolongado). En comparación, la mayoría de los niños diagnosticados con la enfermedad experimentan síntomas leves, una recuperación más rápida, un tiempo de desintoxicación más corto y un buen pronóstico. (19-20)
Diagnóstico diferencial
El cuadro clínico de pacientes afectados por el COVID-19 es semejante en varias de sus presentaciones al cortejo de signos y síntomas generados por otros virus tales como: parainfluenza, adenovirus, virus sincitial respiratorio, rinovirus, metapneumovirus humano, el coronavirus del SARS y otras infecciones virales conocidas, así como micoplasma pneumoniae y la neumonía por clamidia y neumonía bacteriana. La coinfección de 2019-nCoV con otros virus y / o bacterias debe considerarse en el diagnóstico. (20)
Diagnóstico
Para el diagnóstico de COVID 19 en Colombia, se considera un caso confirmado cuando el paciente con síntomas respiratorio agudo y/o fiebre con resultado positivo para nuevo coronavirus 2019 mediante reacción en cadena de polimerasa RT-PCR en tiempo real, pueda tener historia de contacto con personas positivas, también pacientes asintomáticos que tiene RT-PCR positivo (27).
Diagnóstico microbiológico
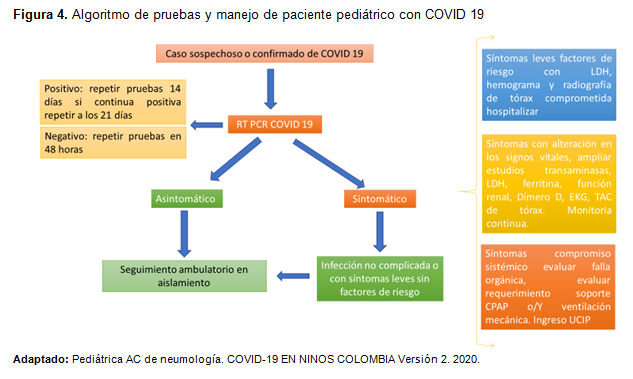
El diagnóstico se realiza mediante RT-PCR con la detección de ácidos nucleicos de la secuenciación del COVID 19, con una sensibilidad en el lavado bronco alveolar (93%), aspirado bronquial o esputo (72%) e hisopado naso y orofaríngeo (63%), mientras se tome adecuadamente y las muestras se mantenga refrigeradas a 4 ◦C, generalmente los falsos negativos pueden suceder por el sitio anatómico, el momento de la toma de la muestra con relación a la fecha de inicio de síntomas como muy cercana al día 14, se recomienda la realización de una segunda prueba de RT-PCR a las 48horas en pacientes con la primera prueba negativa con alta sospecha de neumonía por COVID-19. Los casos positivos se le realizara una segunda prueba a los 14 días si sigue siendo positiva una nuevamente a los 21 días y hasta que el resultado de negativo mantener aislamiento, Figura 4. (28-29-30-31).
Ayudas diagnosticas
La solicitud de hemograma está indicado en todos los pacientes con COVID 19 sus valorares pueden ser normales o con leve disminución de linfocitos, aunque la linfopenia grave se asocia con mortalidad (28-32-33). La proteína C reactiva es un marcador de inflamación se ha encontrado que a mayor elevación de esta mayor mortalidad puede ser secundario a que esta se elevara a mayor daño celular (29,33-34) otros marcadores como la procalcitonina no juega un papel importante en infecciones por COVID 19 (35), la LDH es un marcador también de daño tisular de muchos tejidos uno de esos el pulmonar por lo cual se ha utilizado como marcador de daño alveolar en infecciones pulmonares, una LDH > 350UI/L es indicio del alto riesgo de mortalidad (36). Otras pruebas bioquímicas que se ven afectadas son las elevación de transaminasas, enzimas musculares, mioglobina y dímero D , este último se ha asociado como un marcador de mortalidad, se recomienda la realización de la evaluación SOFA para ayudar a establecer condición actual del paciente y evaluar riesgo de mortalidad (28-31-37).
Las imágenes diagnostica como la radiografía está indicada en la evaluación inicial puede mostrar normalidad y/o infiltrados periféricos intersticiales, opacidades bilaterales en vidrio esmerilado que son las lesiones con mayor frecuencia en etapas iniciales descritas hasta en un 40%, también en la tomografía de tórax el hallazgo con mayor frecuencia es el vidrio esmerilado 57.4% seguidamente de la Ocupación alveolar multilobar y signo de Halo con un 14.1%, nódulo 2.2% y derrame pleural 0.7%. Afectación unilateral en mayor proporción con un 73% y bilateral sobre todo en menores de 3 años con un 27%(28-32-38-39), esta última es de elección en paciente con infección por COVID 19 y se ha evaluado cambios radiográficos dependiendo de los días de infección, en la etapa temprana 0 a 4 días de la enfermedad se observa un patrón en vidrio esmerilado con distribución subpleural e involucrando predominantemente lóbulos inferiores, en la etapa progresiva de 5-8 días después del inicio de los síntomas se observa compromiso bilateral inicio de consolidación de espacios aéreos, próxima etapa pico entre los 9 -13 días se observa mayor densidad de la consolidación la etapa de absorción > 14 días después del inicio de los síntomas no aumenta los cambios observados pero los cambios radiográficos pueden permanecer (28)
Tratamiento
En infecciones no complicadas administrar antitérmicos si se requiere, realizar analítica si continua con buena evolución egreso a casa aislamiento, cuando la afección es leve monitorizar saturación de oxígeno y uso de broncodilataciones si tiene clínica (sibilancias) hospitalización junto a único familiar con medidas de protección, si la afección es grave además de lo anterior, manejo de líquidos determinar uso de volumen 10-20cc/kg, oxigenoterapia >92%, evaluar riesgo SDRA, evaluar sospecha de coinfección y su ingreso a UCIP. Figura 5 (28,38).

Conclusión
Evidentemente la conclusión más contundente, es el bajo porcentaje de niños infectados que presentan la forma severa de la infección por covid-19 aunque se ha demostrado que los niños tienen la misma probabilidad que los adultos de infectarse con el SARS-CoV-2 pero son menos propensos a ser sintomáticos o desarrollar síntomas severos. Se presenta con mayores síntomas la fiebre y tos.
Referencias
- Calvo C, et al. Recomendaciones sobre el manejo clínico de la infección por el «nuevo coronavirus» SARS-CoV2. Grupo de trabajo de la Asociación Española de Pediatría (AEP). An Pediatr (Barc). 2020.
- Hussin A. Rothana, Siddappa N. Byrareddyb. The epidemiology and pathogenesis of coronavirus disease (COVID-19) Outbreak. J Autoimmun. 2020 mayo; 109: 102433.
- Cruz A, Zeichner S. COVID-19 in children: initial characterization of the pediatric disease. Pediatrics. 2020 -0834.
- Pathogenicity and transmissibility of 2019-nCoVdA quick overview and comparison with other emerging viruses Jieliang Chen, J. Chen / Microbes and Infection 22 (2020) 69e71
- Bogoch, A. Watts, A. Thomas-Bachli, C. Huber, M.U.G. Kraemer, K. Khan, Pneumonia of unknown etiology in wuhan, China: potential for international spreadvia commercial air travel, J. Trav. Med. (2020),
- Petra Zimmermann and Nigel Curtis,H.A. Coronavirus Infections in Children Including COVID-19 An Overview of the Epidemiology, Clinical Features, Diagnosis, Treatment and Prevention Options in Children. Pediatr Infect Dis J 2020; XX:00–00)
- Yuefei Jin 1, Haiyan Yang, Wangquan Ji, Weidong Wu, Shuaiyin Chen, Weiguo Zhang and Guangcai Duan Virology, Epidemiology, Pathogenesis, and Control of COVID. Viruses 2020, 12(4), 372
- Zhu, N.; Zhang, D.; Wang,W.; Li, X.; Yang, B.; Song, J.; Zhao, X.; Huang, B.; Shi,W.; Lu, R.; et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N. Engl. J. Med. 2020.
- Mechanisms of Coronavirus Cell Entry Mediated by the Viral Spike Protein, Viruses 2012, 4, 1011-1033; doi:10.3390/v4061011
- Xiao, F.; Tang, M.; Zheng, X.; Li, C.; He, J.; Hong, Z.; Huang, S.; Zhang, Z.; Lin, X.; Fang, Z.; et al. Evidence for gastrointestinal infection of SARS-CoV-2. medRxiv 2020. [CrossRef] [PubMed]
- Cheng, Y.; Luo, R.; Wang, K.; Zhang, M.; Wang, Z.; Dong, L.; Li, J.; Yao, Y.; Ge, S.; Xu, G. Kidney impairment is associated with in-hospital death of COVID-19 patients. medRxiv 2020. [CrossRef]
- Guan, G.W.; Gao, L.; Wang, J.W.; Wen, X.J.; Mao, T.H.; Peng, S.W.; Zhang, T.; Chen, X.M.; Lu, F.M. Exploring the mechanism of liver enzyme abnormalities in patients with novel coronavirus-infected pneumonia. Chin. J. Hepatol. 2020, 28, E002.
- W. Widagdo, Syriam Sooksawasdi Na Ayudhya, Gadissa B. Hundie and Bart L. Haagmans. Host Determinants of MERS-CoV Transmission and Pathogenesis. Viruses 2019, 11(3), 280
- Petra Zimmermann, and Nigel Curtis, Coronavirus Infections in Children Including COVID-19 An Overview of the Epidemiology, Clinical Features, Diagnosis, Treatment and Prevention Options in Children. Pediatr Infect Dis J 2020; XX:00–00
- Yang Lifen, Dai Zhenyuan, Duan Mengqi, et al. Suggestions for medical staff from department of pediatrics during the treatment of 2019-nCoV infection/pneumonia [J]. Journal of New Medicine, 2020.
- Tuo Hu, Liu Fang, Wang Junling, et al. Clinical characteristics of 2019 novel coronavirus (2019‐nCoV) infection in children and family prevention and control [J]. Medical Journal of Wuhan University.
- Chen Feng, Liu Zhi Sheng, Zhang Furong, et al. First case of severe childhood novel coronavirus pneumonia in China [J]. Chin J Pediatr, 2020,58(3):179-183.
- Jiang Yi, Lu Xiaoxia, Jin Runming, et al. Novel coronavirus infections: standard/protocol/guideline recommendations for the diagnosis, prevention and control of the 2019 novel coronavirus infection in children (the second edition) [J]. Chin J Appl Clin Pediatr, 2020, 35(2): 143-150.
- Cai Jiehao, Wang Xiangshi, Ge Yanling, et al. Novel coronavirus infections: case report first case of 2019 novel coronavirus infection in children in Shanghai [J]. Chin J Pediatr, 2020,58(02): 86-87.
- Kunling Shen, Yonghong Yang, Tianyou Wang et al. Diagnosis, treatment, and prevention of 2019 novel coronavirus infection in children: experts’ consensus statement. World Journal of Pediatrics, 2020.
- Chen NS, Zhou M, Dong X, Qu JM, Gong FY, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020.
- Chan JF, Yuan S, Kok KH, Wang KK, Chu H, Yang J, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person to-person transmission: a study of a family cluster. Lancet. 2020
- World Health Organization. Home care for patients with suspected novel coronavirus (nCoV) infection presenting with mild symptoms and management of contacts. https ://www.who.int/inter nal publications-detai l/home-care-for-patients-with-suspected-novel-coronavirus-(nCoV)-infec tion-prese nting -with-mild-symptoms and-management of contacts. Access 20 Jan 2020.
- The US Centers for Disease Control and Prevention. Interim Guidance for Preventing 2019 Novel Coronavirus (2019-nCoV) from Spreading to Others in Homes and Communities. https ://www. cdc.gov/coronavirus/2019-ncov/guidance-prevent-sprea d-chinese.html. Access 20 Jan 2020
- Pediátrica AC de neumología. COVID-19 EN NIÑOS COLOMBIA Versión 2. 2020.
- Joseph DT, Moslehi DMA. International Pulmonologist’s Consensus On Covid-19. Vol. 1. 2020. p43.
- Instituto Nacional de Salud. Instructivo para la vigilancia en salud pública intensificada de infección respiratoria aguda asociada al nuevo coronavirus 2019 (COVID-19). 2020 p. 1–26.
- Calvoa C, López-Hortelanoa MG, Vicente JC de C, Martínez JLV, De G de trabajo de la AE de P para el brote, Sanidad. Recomendaciones sobre el manejo clínico de la infección por el « nuevo coronavirus » SARS-CoV2 . An Pediatr. 2020;1–11.
- Iets GA-ID de los casos de infección por S-C-2/COVID-19, Colombiano C. IV. Diagnóstico de los casos de infección por SARS-CoV-2/COVID-19. In: Consenso colombiano de atención , diagnóstico y manejo de la infección por SARS-COV-2 / COVID-19 en establecimientos de atención de la salud Recomendaciones basadas en consenso de expertos e informadas en la evidencia. 2020. p. 1–102.
- Wahidi MM, Lamb C, Murgu S, Musani A, Shojaee S, Sachdeva A, et al. American Association for Bronchology and Interventional Pulmonology (AABIP) Statement on the Use of Bronchoscopy and Respiratory Specimen Collection in Patients with Suspected or Confirmed COVID-19 Infection. J Bronchology Interv Pulmonol. 2020;1.
- Jin Y, Wang M, Zuo Z, Fan C, Ye F, Cai Z, et al. Diagnostic value and dynamic variance of serum antibody in coronavirus disease 2019. Int J Infect Dis. 2020 Apr;
- Zhao J, Yuan Q, Wang H, Liu W, Liao X, Su Y, et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clin Infect Dis. 2020 Mar;
- María José Fernández de Sanmamed Santos, Laia Riera Armengol ESF. ¿Y después de la fase aguda del COVID-19 qué...? 2020.
- Li Z, Yi Y, Luo X, Xiong N, Liu Y, Li S, et al. Development and Clinical Application of A Rapid IgM-IgG Combined Antibody Test for SARS-CoV-2 Infection Diagnosis. J Med Virol. 2020 Feb;
- Guan W, Ni Z, Hu Y, Liang W, Ou C, He J, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med [Internet]. 2020 Feb 28; Available from: https://doi.org/10.1056/NEJMoa2002032
- Shen K, Yang Y, Wang T, Zhao D, Jiang Y, Jin R, et al. Diagnosis, treatment, and prevention of 2019 novel coronavirus infection in children: experts’ consensus statement. World J Pediatr [Internet]. 2020;(0123456789). Available from: https://doi.org/10.1007/s12519-020-00343-7
- Ludvigsson JF. Systematic review of COVID-19 in children shows milder cases and a better prognosis than adults. Acta Paediatr. 2020;0–3.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan , China : a retrospective cohort study. Thelancet. 2020;6736(20):1–9.
- Lu X, Zhang L, Du H, Zhang J, Li YY, Qu J, et al. SARS-CoV-2 Infection in Children. N Engl J Med [Internet]. 2020 Mar 18;NEJMc2005073. Available from: https://pubmed.ncbi.nlm.nih.gov/32187458
- Xia W, Shao J, Guo Y, Peng X, Li Z, Hu D. Clinical and CT features in pediatric patients with COVID-19 infection: Different points from adults. Pediatr Pulmonol. 2020 Mar;
- Who W. Clinical management of severe acute respiratory infection ( SARI ) when COVID-19 disease is suspected. 2020;2019(December 2019).
- Kneyber MCJ, de Luca D, Calderini E, Jarreau PH, Javouhey E, Lopez-Herce J, et al. Recommendations for mechanical ventilation of critically ill children from the Paediatric Mechanical Ventilation Consensus Conference (PEMVECC). Intensive Care Med. 2017;43(12):1764–80.
- Kneyber MCJ, MD AM, MD VM i A, Blokpoel R, MD JB, Chidini G, et al. Practice recommendations for the management of children with suspected or proven COVID-19 infections from the Paediatric Mechanical Ventilation Consensus Conference ( PEMVECC ) and the section Respiratory Failure from the European Society for Paediatric a. Eur Soc Paediatr Neonatal Intensive Care. 2020;1–7.
- Wong JJM, Lee SW, Tan HL, Ma Y-J, Sultana R, Mok YH, et al. Lung-Protective Mechanical Ventilation Strategies in Pediatric Acute Respiratory Distress Syndrome. Pediatr Crit Care Med | Soc Crit Care Med [Internet]. 2020; Available from: https://journals.lww.com/pccmjournal/Fulltext/onlinefirst/Lung_Protective_Mechanical_Ventilation_Strategies.98059.aspx
- Petrucci N, De Feo C. Lung protective ventilation strategy for the acute respiratory distress syndrome. Cochrane Database Syst Rev [Internet]. 2013;(2). Available from: https://doi.org//10.1002/14651858.CD003844.pub4
- Gattinoni L, Chiumello D, Caironi P, Busana M, Romitti F, Brazzi L, et al. COVID-19 pneumonia : different respiratory treatment for different phenotypes ? Intensive Care Med. 2020;1–6.
- Berger JT, Maddux AB, Reeder RW, Banks R, Mourani PM, Berg RA, et al. Inhaled Nitric Oxide Use in Pediatric Hypoxemic Respiratory Failure. Pediatr Crit Care Med | Soc Crit Care Med [Internet]. 2020; Available from: https://journals.lww.com/pccmjournal/Fulltext/onlinefirst/Inhaled_Nitric_Oxide_Use_in_Pediatric_Hypoxemic.98061.aspx
- Ventilation ES for P and NICPM. Managing the child with proven or seriously suspected Covid-19 infection, Paediatric Mechanical Ventilation Consensus Conference & Section Respiratory Failure. In: Consensus Conference & Section Respiratory Failure. 2020.
|

