Introducción
La neumonía sigue siendo una de las causas más importantes de morbilidad y mortalidad infantil. La incidencia en menores de 5 años es de más de 100 millones de casos cada año1-4. La neumonía necrotizante corresponde a una complicación infrecuente y se refiere a necrosis del parénquima pulmonar, que en ocasiones precede a otras complicaciones como el absceso pulmonar5. El conocimiento de esta patología está basado principalmente en reportes de casos y series de pacientes6. Si bien la incidencia de neumonía necrotizante se ha descrito como muy baja, en las últimas décadas se ha visto un incremento de hasta un 7% de los casos de neumonías adquiridas en la comunidad y de hasta un 20% de las que se complican con empiema7. Los agentes más frecuentemente identificados corresponden a Streptococcus pneumoniae, seguido de Staphylococcus aureus, Mycoplasma pneumoniae y Klebsiella Spp8. Uno de los pilares del tratamiento consiste en la antibioticoterapia prolongada, no existiendo consenso sobre la duración ni de las condiciones en que estaría indicado intervenir quirúrgicamente a estos pacientes7. A nivel nacional no existen revisiones clínicas recientes en población pediátrica. Hace más de 15 años y previo a la vacunación contra el neumococo en Chile, Lozano J. realizó un estudio que reunió 32 pacientes con neumonía necrotizante entre 1997 y 200410. El presente artículo corresponde a una revisión retrospectiva de los casos de neumonía necrotizante en pacientes del Hospital de Niños Roberto del Río post era vaccinal contra neumococo durante el período 2014 – 2020, que busca caracterizar clínicamente a los pacientes que cursaron con este cuadro. La información obtenida será de utilidad al momento de desarrollar directrices locales de manejo, actualizar el conocimiento respecto a esta patología y aportar datos de la realidad a nivel local.
Material y Método
Estudio de tipo retrospectivo y descriptivo. Se realizó búsqueda en la base de datos computacional del Hospital Roberto del Río de los pacientes ingresados o egresados bajo el diagnóstico de neumonía necrotizante, registrados entre enero de 2014 y octubre de 2020. Se analizaron los datos obtenidos de la ficha clínica electrónica. Para la búsqueda se utilizaron los diagnósticos CIE 10: absceso del pulmón con neumonía; absceso del pulmón sin neumonía; derrame pleural no clasificado en otra parte; derrame pleural en afecciones clasificadas en otra parte; otras afecciones especificadas de la pleura; afección pleural, no especificada; piotórax con fístula; piotórax sin fístula y neumonía bacteriana, no especificada. Se obtuvieron 1692 casos de neumonía bacteriana, 114 casos de derrame pleural, 15 de piotórax y 2 casos de absceso pulmonar. De estos se identificaron aquellos pacientes que fueron hospitalizados y diagnosticados como neumonía necrotizante, y que fueron catalogados como tal al egreso en la epicrisis o que presentaron diagnóstico compatible con esta enfermedad por hallazgos clínicos y radiológicos. Se obtuvieron datos de la ficha clínica en aspectos demográficos (edad, sexo), clínicos (forma de presentación: tos, fiebre, disnea, dolor torácico, antecedentes mórbidos, días de hospitalización total, días de antibiótico, días de hospitalización hasta el diagnostico), estudio de laboratorio (Proteína C Reactiva (PCR), recuento de leucocitos, líquido pleural y sus características), microbiológico (hemocultivo y cultivo de líquido), radiológicos (tipo de imagen: radiografía, ecografía o Tomografía computarizada (TC)), días de estadía en sala, y en unidad de cuidados intensivos, requerimientos de ventilación mecánica invasiva o no invasiva, complicaciones, procedimientos quirúrgicos (toracocentesis, videotoracoscopía), complicaciones post-quirúrgicas y mortalidad. Los datos obtenidos se registraron a una planilla Excel ad hoc anonimizada para su análisis posterior. Dicha información se expresó como valores absolutos, porcentajes o media según fuera el caso. Se solicitó firma de consentimiento informado a los tutores o padres de participantes que fueron identificados con diagnósticos compatibles con neumonía necrotizante. Este consentimiento fue solicitado de forma presencial o mediante comunicación remota (correo electrónico). El presente estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad de Chile y autorizado por la dirección del Hospital Roberto del Río. Se excluyó a aquellos pacientes que no dieron consentimiento para uso de sus datos.
Resultados
Se identificó un total de 22 pacientes con diagnóstico compatible de neumonía necrotizante en el período analizado. Las características demográficas se describen en la tabla 1. El promedio de edad de los pacientes fue de 4 años 7 meses, rango 11 meses y 16 años 8 meses El 72.7% tenía entre 2 y 10 años. La mayoría fueron varones (68.2%) y un poco más de la mitad tenía antecedentes de patología previa: síndrome bronquial obstructivo recurrente 1 caso, epilepsia 2 casos parálisis cerebral, déficit intelectual, microcefalia, síndrome de Down 3, cardiopatía congénita 2 y neumonía necrotizante previa 1 caso.
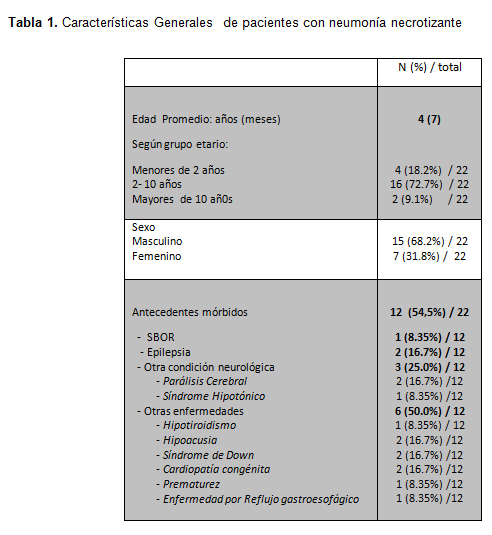
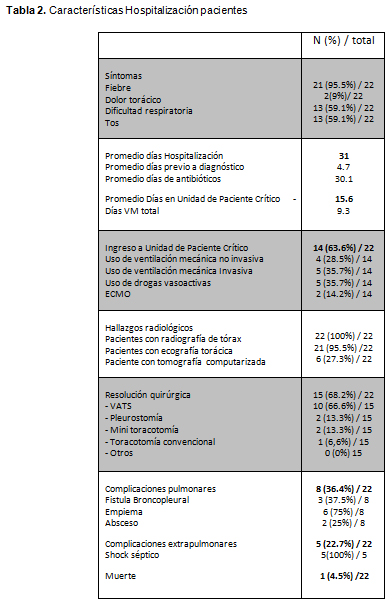
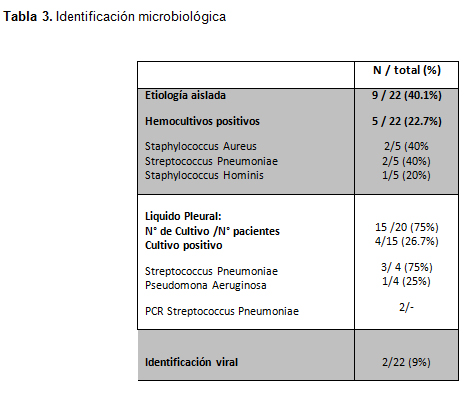
El 40.9% de los casos de neumonía necrotizante ocurrió en el 2019 y el resto se distribuyó homogéneamente en el resto de años evaluados, con excepción de 2017, en que no se registraron casos. En el 2019 se registraron 9 casos, con una incidencia de 2,6 casos por cada 100 casos de neumonía bacteriana hospitalizada (1,3 casos por cada 100 en promedio para los 7 años medidos, de un total de 1692 casos identificados). Las características clínicas de los pacientes hospitalizados por neumonía necrotizante, éstas se resumen en la Tabla 2. De la totalidad de paciente, un 95.5% cursó con fiebre y más de la mitad de los casos se asociaron a dificultad respiratoria y tos (59.1%), mientras que sólo en un caso se presentó como dolor torácico. El promedio de duración de la hospitalización fue de 31 días, siendo la más larga de 119 días. En promedio se tardó casi 5 días desde el ingreso para hacer el diagnostico de neumonía necrotizante. Todos los pacientes recibieron antibióticos, con una duración promedio más de 30 días. Los antibióticos utilizados con más frecuencia fue cefotaxima (77.2%), cloxacilina (50%) y clindamicina (31.2%) amoxicilina (27%) y amoxicilina + ácido clavulánico (18.2%). Estos últimos fueron indicados para completar tratamiento de forma ambulatoria. Un 18.2% de los pacientes requirió escalar el tratamiento a Vancomicina y 9% a linezolid y colistin. Más de la mitad de los pacientes de nuestra serie requirió ingresar a unidad de paciente critico (63,6%) para su manejo, de los cuales un 29.5% fue apoyado con ventilación mecánica no invasiva, un 35,7% con ventilación mecánica invasiva y un 35,7% recibió drogas vasoactivas. Destacan en nuestro estudio dos pacientes que por su condición crítica requirieron apoyo con oxigenación por membrana extracorpórea (ECMO). Los parámetros de laboratorio más frecuentemente alterados fueron el recuento de leucocitos, con promedio de 18.100 (rango 2.500 a 35.000) y 59% >15.000 leucocitos y neutrófilos > 50% en un 86% de los casos. La PCR promedio fue de 211 mg/L al ingreso (rango 10 a 417 mg/L) y 68% de los casos presentó PCR > 100 mg/L al ingreso. Solo se accedió a las características citológicas y fisicoquímicas del líquido pleural en 6 casos, todos compatibles con empiema. Todos los pacientes fueron evaluados con radiografía de tórax, aunque en solo un caso se realizó diagnóstico con esta técnica. En la mayoría de las radiografías se identificó derrame pleural (86.4%) y condensación pulmonar (63.7%), pero en el 95.5% de los pacientes se realizó el diagnóstico mediante ecografía de tórax. Los hallazgos fueron: derrame pleural (76.2%), necrosis pulmonar (42.9%), zonas de hipoperfusión pulmonar (42.9%) y cavitación (23.8%). Sólo en 6 casos se realizó TC de tórax, aunque en todos los casos el diagnóstico ya se había obtenido previamente. Los hallazgos de la tomografía fueron derrame pleural en 3 casos, neumatocele en 2 y cavitación en 2 casos. En cuanto al estudio microbiológico, todos los pacientes fueron hemocultivados, con una tasa de positividad de un 22,7% (5 pacientes): S. pneumoniae (40%), S. aureus (40%) y S. hominis (1 caso considerado contaminación). En el paciente con hemocultivo positivo para S. aureus, la cepa fue productora de Leucocidina panton valentine. Del total de pacientes con derrame pleural, se cultivó en 15 casos, resultando 4 positivos a S. Pneumoniae. En dos casos se documentó coinfección viral con adenovirus y parainfluenza. La tabla 3 resume los agentes etiológicos identificados. Las intervenciones quirúrgicas se realizaron en más de la mitad de los casos (63,6%), siendo la cirugía toracoscópica asistida por video (VATS) la más utilizada en un 71.4%. En un 36,4% de los casos se desarrollaron complicaciones pulmonares: empiema y fístula broncopleural. En 5 pacientes se observó cursaron con shock séptico y solo uno falleció, recibió ECMO y se identificó S. aureus panton valentine positivo.
 |
 |
Discusión
La neumonía necrotizante corresponde a una de las complicaciones más serias de la neumonía adquirida en la comunidad y generalmente es consecuencia de alguna bacteria particularmente virulenta8. Este término se utiliza para denotar la presencia de necrosis en parénquima pulmonar y frecuentemente precede a complicaciones como el absceso pulmonar y pneumatocele5. El término neumonía necrotizante reviste progresión en gravedad clínica, asociando mayor morbimortalidad5. Esta complicación se presenta generalmente en pacientes previamente sanos y sin comorbilidades11. Si bien la incidencia de neumonía necrotizante descrita es muy baja, en las últimas décadas se ha visto un incremento de hasta un 7% de los casos en neumonías adquiridas en la comunidad y de hasta un 20% de las que se complican con empiema7. Se piensa que dicho aumento responde en parte a la mayor sospecha y conocimiento médico de la entidad, a la mayor disponibilidad de técnicas de imagen diagnósticas y al aumento de la resistencia antibiótica. En la actualidad, aproximadamente un 3,7% de todas las neumonías adquiridas en la comunidad en pacientes hospitalizados son necrotizantes, siendo la edad promedio de presentación en niños de 4 años, y en la mayoría, inmunocompetentes12.
En nuestro estudio en un hospital de niños de referencia para una parte del área norte del nuestro país encontramos 22 casos de neumonía necrotizante en los últimos 7 años, teniendo un mayor número de casos en el 2019, aunque el resto de años se presentó una incidencia más bien homogénea. A pesar de que el número de casos es pequeño, es posible identificar diversos aspectos relevantes. En nuestra serie, para el año de más casos (2019) se calculó una incidencia de 2,6% de casos de neumonía en hospitalizados, y en promedio una prevalencia de 1,3% en la totalidad de los años estudiados, lo que está por debajo de lo que se informa en publicaciones internacionales. Es posible que esto pueda explicarse en parte por la presencia de vacunas antineumocócicas que han permitido disminuir la incidencia de casos graves de neumonía.
El promedio de edad de nuestros pacientes fue de 4 años 7 meses y pese a que la gran mayoría tenía alguna comorbilidad, en su totalidad fueron inmunocompetentes, coincidiendo con lo que se describe en la literatura12 y similar a lo descrito en nuestro país por Lozano et al10. En esta última revisión se obtuvo un promedio de edad más bajo que nuestro estudio (36 meses); en este reporte de un periodo de tiempo similar al nuestro se encontraron más casos que en nuestro estudio, lo que plantea que la incidencia de esta patología podría ir a la baja. Se observa una mayor tendencia en hombres, difícil de definir por el pequeño número de casos7.
La literatura describe que la sintomatología más frecuentemente asociada a neumonía necrotizante incluye fiebre (96%), dificultad respiratoria (90%) y tos (84%), con un laboratorio característico en que destacan a parámetros inflamatorios elevados, por lo general proteína C reactiva (PCR) mayor a 100 mg/L12. Esto se observó en nuestra serie, en quienes la fiebre se presentó en casi la totalidad de los casos, y la dificultad respiratoria y tos en menor proporción. La gran mayoría de nuestros pacientes tuvo PCR elevada al ingreso. En las series internacionales se describe que hasta en un 85% de los casos de neumonía necrotizante existe derrame paraneumónico12, lo cual concuerda con lo descrito en nuestra serie (86.4%). El estudio con radiografía de tórax puede evidenciar imágenes sugerentes de neumonía necrotizante, pero tiene baja sensibilidad en etapas precoces de la necrosis pulmonar (25%) En nuestro estudio sólo en un caso se diagnosticó neumonía necrotizante mediante radiografía. Por esta razón la técnica de imagen de elección es la TC de tórax con contraste7,13. La TC de tórax permite evidenciar cavitaciones, inflamación irregular del parénquima pulmonar con microabscesos, áreas de hipoperfusión y presencia de neumatoceles13, además de diferenciar lesiones necróticas de abscesos14. En la gran mayoría de nuestros pacientes (95.5%), el diagnóstico se obtuvo mediante la ecografía torácica. Es bien conocido en la literatura el rol de la ecografía torácica como herramienta diagnóstica de utilidad, que en manos entrenadas puede evaluar el espacio pleural, parénquima pulmonar y con el apoyo del doppler detectar zonas de hipoperfusión14. Un estudio retrospectivo encontró buena correlación entre la ecografía torácica y la TC de tórax en pacientes con neumonía adquirida en la comunidad que presentaban necrosis pulmonar14. Los hallazgos más frecuentes descritos en las ecografías torácicas de esta serie fueron áreas evidentes de necrosis y zonas de hipoperfusión del parénquima, además de derrame pleural en la mayoría de los pacientes. En nuestra serie se realizó en pocas ocasiones la TC de tórax, con un uso enfocado a la búsqueda de complicaciones más que como herramienta diagnóstica. Ésta se utilizó en seis pacientes, en quienes los hallazgos más frecuentes fueron necrosis y cavitación. Se debe recalcar que en manos de un especialista entrenado la ecografía de tórax resulta un método sensible, ampliamente disponible y asociado a menos complicaciones e irradiación del paciente14.
El estudio de pacientes que cursan con neumonía necrotizante debe complementarse con análisis de líquido pleural si existe derrame, el cual puede presentar características de empiema (pus, microorganismos visibles al Gram, leucocitos polimorfonucleares elevados, pH menor a 7.2, proteínas aumentadas, glucosa disminuida y LDH elevada)7. De nuestros pacientes solo en 6 se analizó el líquido pleural de forma exitosa, todos compatibles con empiema.
La búsqueda etiológica incluyó hemocultivos, cultivos y estudio en líquido pleural. El rendimiento general de los estudios microbiológicos en pacientes con neumonía necrotizante descrito en la literatura oscila entre un 8 – 55%7. Uno de los factores que más influye en el bajo rendimiento global es la administración de antibióticos previo a la toma de cultivos, lo que ocurre entre el 44 – 100% de los pacientes. Un estudio comparativo concluyó que la positividad de los estudios disminuyó de un 64% a un 22% al contrastar pacientes que no habían recibido antibióticos versus los que si los habían recibido15. Según la literatura los agentes más frecuentemente aislados corresponden a Streptococcus pneumoniae, Staphylococcus aureus, Mycoplasma penumoniae y Klebsiela Spp8. El Staphylococcus aureus meticilino resistente (SAMR) es más común en niños en torno a los 4 años y se asocia a infección viral previa16. La mayoría de los serotipos relacionados con casos de neumonías necrotizantes por Streptococcus pneumoniae corresponden a serotipos no incluidos en la vacuna 7 valente. Asimismo, se ha descrito que posterior a la inclusión de la vacuna 13 valente en EEUU y Francia, se observó un descenso de entre un 37% - 53% de los casos de neumonía necrotizante y empiemas17. En nuestro grupo de pacientes se aisló el agente etiológico en un 40.1% de los casos, siendo más frecuente el Streptoccocus pneumoniae (44.4%), seguido por S. aureus (22,2%), muy similar a lo descrito en estudios internacionales. Se obtuvo una positividad de 22.7% en relación a hemocultivos y 26.7% en los cultivos de líquido pleural. Destaca un caso en particular en que se aisló S. aureus con presencia de factor de virulencia panton-valentine, que correspondió al paciente con la hospitalización más prolongada del estudio, siendo uno de los dos pacientes que requirieron conexión a ECMO y falleciendo durante la estadía. A este factor de virulencia se le ha adjudicado un rol importante en la patogenia de neumonías necrotizantes estafilocócicas severas, siendo responsable de la necrosis tisular como resultado del daño mediado por la activación fagocítica y la destrucción linfocitaria18-19.
Estudios internacionales sobre neumonías necrotizantes describen un promedio de hospitalización de 27 días con un promedio de uso de antibióticos de hasta 23 días20. Esto es similar a lo reportado en nuestro estudio en donde se alcanzó un promedio de hospitalización de 31 días y uso de antibióticos de 30 días. Contrasta con estudios locales que muestran estadías hospitalarias más cortas, que oscilan entre 15 y 22 días10. Este hecho pone en evidencia que nuestros pacientes eran más graves que lo descrito en la literatura nacional y debido a ello es que nuestra estadía hospitalaria fue más larga, requirió mayor número de intervenciones quirúrgicas y hubo un mayor número de pacientes ingresados a Unidades de Pacientes Críticos La mayoría de los pacientes requirieron manejo en UPC (63.6%), más de la mitad de estos ventilación mecánica invasiva y dos casos ECMO.
El tratamiento antibiótico prolongado es la piedra angular del manejo. La duración óptima del tratamiento no está definida claramente y se encuentran reportes muy diversos en la literatura, desde 13 a 42 días, con un promedio de 28 días7,12, lo que da una idea de la gran variabilidad en la evolución clínica de estos pacientes. En nuestra serie la duración promedio del tratamiento antibiótico fue de 30 días. No está definido el esquema antibiótico de elección, pero en nuestro centro los más utilizados fueron cefotaxima, cloxacilina y clindamicina vía endovenosa y amoxicilina o amoxicilina/ácido clavulánico para continuación de tratamiento vía oral de forma ambulatorio, teniendo resultados favorables en casi la totalidad de los casos.
Frente al empeoramiento de la condición clínica, mala respuesta a tratamiento y evolución tórpida del paciente, puede ser necesaria la intervención quirúrgica. Existe controversia respecto a cuándo sería oportuno el manejo quirúrgico y cuál debiera ser el enfrentamiento preferencial. En la mayor parte de la literatura, una aproximación quirúrgica es recomendada en casos de deterioro clínico o de complicación7,21. Existen diversas técnicas y enfrentamientos quirúrgicos, incluyendo la pleurostomía, videotoracoscopía, mini toracotomía, toracotomía convencional e incluso lobectomia7. Las complicaciones como la fístula broncopleural también suelen ser indicaciones más clásicas de manejo quirúrgico22.
Esta falta de criterios categóricos respecto a la indicación quirúrgica también se refleja en nuestro estudio. En términos generales, la gran mayoría de los pacientes requirió intervención quirúrgica de algún tipo, siendo por lejos lo más frecuente la realización de VATS (66.6%). En mucho menor medida se realizó pleurostomía o mini-toracotomía. En la mayoría de los casos la conducta quirúrgica se planteó en relación a la necesidad de drenaje de empiema y en menos casos para la resolución de fístula bronco-pleural. Será necesario determinar directrices más exactas para manejo quirúrgico de estos pacientes.
En nuestra serie se registró el fallecimiento de un paciente con S. aureus Panton valentine positivo, factor conocido por aumentar la mortalidad en pacientes con neumonía necrotizante23.
Nuestro estudio presenta desventajas, ya que es retrospectivo y con escaso número de pacientes. Considerando a la neumonía necrotizante como una entidad poco frecuente, este estudio se asemeja en número de pacientes a estudios nacionales e internacionales. La ventaja es que se trata de un estudio nacional en la era post vaccinal de neumococo y que se pudo detallar plenamente la historia, diagnóstico y tratamiento de los pacientes.
Creemos que este estudio contribuye a describir una realidad local en características y comportamiento de pacientes con neumonía necrotizante en nuestro medio donde hay poca información sobre la epidemiología local. Este estudio aporta información necesaria para revisar protocolos de manejo antibiótico y quirúrgico.
Agradecimientos
Klga. Karla Yohannessen (PhD) y Dra. María Angélica Palomino en análisis estadístico y redacción.
Referencias
- Ouldali N, Levy C, Minodier P, et al. Long-term Association of 13-Valent Pneumococcal Conjugate Vaccine Implementation With Rates of Community-Acquired Pneumonia in Children. JAMA Pediatr. 2019;173(4):362–370. doi:10.1001/jamapediatrics.2018.5273
- Rudan I, O'Brien KL, Nair H, Liu L, Theodoratou E, Qazi S, et al; Child Health Epidemiology Reference Group (CHERG). Epidemiology and etiology of childhood pneumonia in 2010: estimates of incidence, severe morbidity, mortality, underlying risk factors and causative pathogens for 192 countries. J Glob Health. 2013 Jun;3(1):010401. doi: 10.7189/jogh.03.010401. PMID: 23826505; PMCID: PMC3700032.
- McAllister DA, Liu L, Shi T, Chu Y, Reed C, Burrows J, et al. Global, regional, and national estimates of pneumonia morbidity and mortality in children younger than 5 years between 2000 and 2015: a systematic analysis. Lancet Glob Health. 2019 Jan;7(1):e47-e57. doi: 10.1016/S2214-109X(18)30408-X. Epub 2018 Nov 26. PMID: 30497986; PMCID: PMC6293057.
- Bradley JS, Byington CL, Shah SS, Alverson B, Carter ER, Harrison C, et al ; Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. The management of community-acquired pneumonia in infants and children older than 3 months of age: clinical practice guidelines by the Pediatric Infectious Diseases Society and the Infectious Diseases Society of America. Clin Infect Dis. 2011 Oct;53(7):e25-76. doi: 10.1093/cid/cir531. Epub 2011 Aug 31. PMID: 21880587; PMCID: PMC7107838.
- Messinger AI, Kupfer O, Hurst A, Parker S. Management of Pediatric Community-acquired Bacterial Pneumonia. Pediatr Rev. 2017 Sep;38(9):394-409. doi: 10.1542/pir.2016-0183. PMID: 28864731.
- Hasan RA, Al-Neyadi S, Abuhasna S, Black CP. High-frequency oscillatory ventilation in an infant with necrotizing pneumonia and bronchopleural fistula. Respir Care. 2011 Mar;56(3):351-4. doi: 10.4187/respcare.00697. Epub 2010 Nov 16. PMID: 21235845.
- Masters IB, Isles AF, Grimwood K. Necrotizing pneumonia: an emerging problem in children? Pneumonia (Nathan). 2017 Jul 25;9:11. doi: 10.1186/s41479-017-0035-0. PMID: 28770121; PMCID: PMC5525269.
- Sawicki GS, Lu FL, Valim C, Cleveland RH, Colin AA. Necrotising pneumonia is an increasingly detected complication of pneumonia in children. Eur Respir J. 2008 Jun;31(6):1285-91. doi: 10.1183/09031936.00099807. Epub 2008 Jan 23. PMID: 18216055.
- Nombera JA, Acuña R, Navarro H, Caussade S, Zúñiga S, García C y Sánchez I. Doce casos de absceso pulmonar en pediatría: revisión clínica. Rev. chil. Pediatr 2001; 72(2): 128-134.
- Lozano J. Complicaciones respiratorias asociadas a neumonía bacteriana. Neumología Pediatrica 2007; 2 :70–5.
- Krenke K, Sanocki M, Urbankowska E, Kraj G, Krawiec M, Urbankowski T, et al. Necrotizing Pneumonia and Its Complications in Children. Adv Exp Med Biol. 2015;857:9-17. doi: 10.1007/5584_2014_99. PMID: 25468010.
- Nicolaou EV, Bartlett AH. Necrotizing Pneumonia. Pediatr Ann. 2017 Feb 1;46(2):e65-e68. doi: 10.3928/19382359-20170120-02. PMID: 28192581.
- Ramgopal S, Ivan Y, Medsinge A, Saladino RA. Pediatric Necrotizing Pneumonia: A Case Report and Review of the Literature. Pediatr Emerg Care. 2017 Feb;33(2):112-115. doi: 10.1097/PEC.0000000000000585. PMID: 26785088.
- Lai SH, Wong KS, Liao SL. Value of Lung Ultrasonography in the Diagnosis and Outcome Prediction of Pediatric Community-Acquired Pneumonia with Necrotizing Change. PLoS One. 2015 Jun 18;10(6):e0130082. doi: 10.1371/journal.pone.0130082. PMID: 26086718; PMCID: PMC4472812.
- Erlichman I, Breuer O, Shoseyov D, Cohen-Cymberknoh M, Koplewitz B, Averbuch D, et al. Complicated community acquired pneumonia in childhood: Different types, clinical course, and outcome. Pediatr Pulmonol. 2017 Feb;52(2):247-254. doi: 10.1002/ppul.23523. Epub 2016 Jul 8. PMID: 27392317.
- McAdams RM, Mazuchowski E, Ellis MW, Rajnik M. Necrotizing staphylococcal pneumonia in a neonate. J Perinatol. 2005 Oct;25(10):677-9. doi: 10.1038/sj.jp.7211364. PMID: 16193079.
- Angoulvant F, Levy C, Grimprel E, Varon E, Lorrot M, Biscardi S, et al. Early impact of 13-valent pneumococcal conjugate vaccine on community-acquired pneumonia in children. Clin Infect Dis. 2014 Apr;58(7):918-24. doi: 10.1093/cid/ciu006. Epub 2014 Feb 13. PMID: 24532543.
- Shilo N, Quach C. Pulmonary infections and community associated methicillin resistant Staphylococcus aureus: a dangerous mix? Paediatr Respir Rev. 2011 Sep;12(3):182-9. doi: 10.1016/j.prrv.2010.10.007. Epub 2010 Nov 20. PMID: 21722847.
- Hoppe PA, Holzhauer S, Lala B, Bührer C, Gratopp A, Hanitsch LG, et al. Severe infections of Panton-Valentine leukocidin positive Staphylococcus aureus in children. Medicine (Baltimore). 2019 Sep;98(38):e17185. doi: 10.1097/MD.0000000000017185. PMID: 31567961; PMCID: PMC6756729.
- Veras TN, Bertelli L, Zemczak N, Elisa C, Louise R, Melo AC. Necrotizing pneumonia in children: Experience in a pediatric tertiary care hospital. European Respiratory Journal 2016; 48: 1280.
- Dalponte RS, Heluany GCV, Michels M, Madeira K, Prado CE. Surgical treatment of necrotizing pneumonia in children: a 10-year assessment. Rev Col Bras Cir. 2020 Mar 27;47:e20202374. Portuguese, English. doi: 10.1590/0100-6991e-20202374. PMID: 32236292.
- Westphal FL, Lima LC, Netto JC, Tavares E, Andrade Ede O, Silva Mdos S. Surgical treatment of children with necrotizing pneumonia. J Bras Pneumol. 2010 Nov-Dec;36(6):716-23. English, Portuguese. PMID: 21225174.
- Gillet Y, Issartel B, Vanhems P, Fournet JC, Lina G, Bes M, et al. Association between Staphylococcus aureus strains carrying gene for Panton-Valentine leukocidin and highly lethal necrotising pneumonia in young immunocompetent patients. Lancet. 2002 Mar 2;359(9308):753-9. doi: 10.1016/S0140-6736(02)07877-7. PMID: 11888586.
|

