Introducción
La fibrosis quística (FQ) es la enfermedad crónica, de origen genético, con herencia autosómica recesiva más frecuente en caucásicos1,2,3 Es causada por una mutación en el gen que codifica para la proteína CFTR (reguladora de la conductancia transmembrana de la fibrosis quística), que actúa como canal del cloro localizado en la membrana apical del epitelio secretor de las glándulas mucosas de la vía aérea, digestiva, reproductora y en las serosas del sudor y saliva, función vital para el funcionamiento mucociliar adecuado4. Se ha descrito la presencia del canal CFTR en las células alfa y beta del páncreas5.
Debido a la mayor sobrevivencia de esta patología, la diabetes relacionada a la FQ (DRFQ) es la complicación extra pulmonar más frecuente en los sujetos que alcanzan la edad adulta1,6-8. Entre los factores predisponentes de DRFQ se han identificado el género femenino, la edad, las mutaciones genéticas de clase I y II, los homocigotos para p.Phe508del, la insuficiencia pancreática exocrina, el grado de deterioro de la función pulmonar, el uso de corticoides y la presencia de otras complicaciones de la FQ simultáneas, como son la enfermedad hepática y el trasplante pulmonar1,8. Típicamente la DRFQ se diagnostica en la adolescencia tardía, con una edad media al diagnóstico entre los 18 y 25 años1,9. Puede aparecer a cualquier edad, pero lo más frecuente es que la prevalencia aumente con ella, siendo en Estados Unidos de 9% a los 5-9 años, 26% a los 10 a 20 años y hasta 50% a los 30 años1,2,10-12. Existen muy pocos reportes sobre las alteraciones en el metabolismo de la glucosa en pacientes prepuberales con FQ y escasas publicaciones de DRFQ en preescolares a nivel mundial13-15. En Chile se desconoce su prevalencia y no existen registros estadísticos nacionales en preescolare16. Esto es importante ya que se ha descrito que la diabetes tiene un alto impacto en la morbimortalidad y en la calidad de vida de pacientes con FQ en6,8,10. El objetivo del presente artículo es reportar tres casos de niños con FQ y diagnóstico de diabetes a muy temprana edad, destacando la existencia de esta patología en un rango etario diferente a lo descrito en la literatura.
Caso 1
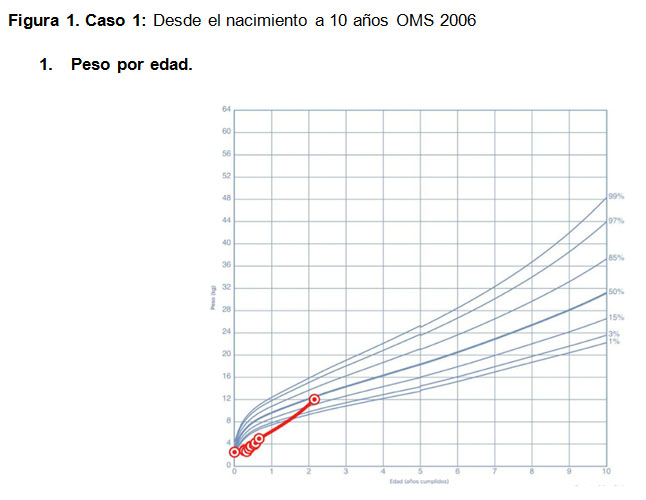
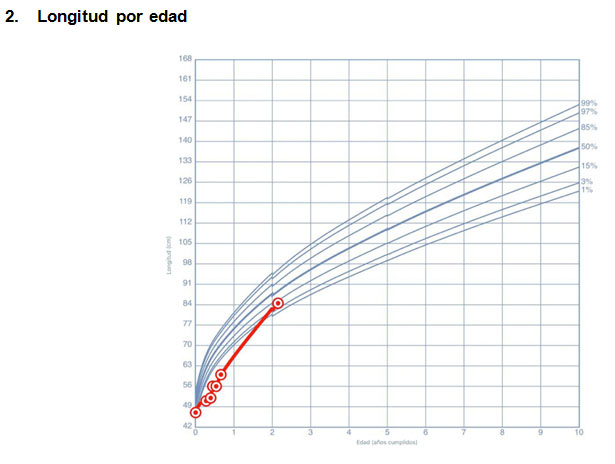
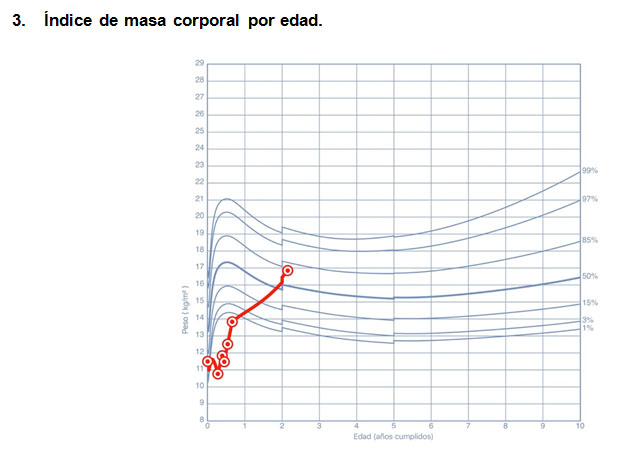
Paciente de sexo masculino de 8 años, que nace a las 38 semanas pequeño para la edad gestacional (PEG) severo, peso de nacimiento 2540 gramos. Se hospitaliza al mes de vida por mal incremento ponderal y anemia severa. Evoluciona con infección respiratoria baja con requerimiento de oxígeno persistente diagnosticándose FQ a los 3 meses de edad por test de sudor alterado con cloro 129 mEq/l y estudio genético p.Phe508del /-. Presenta aumento de transaminasas asociado a hepatomegalia, función tiroidea normal, cariograma normal, se detecta Pseudomona Aeruginosa (PA) en secreción traqueal. Se mantuvo hospitalizado entre los 3 y 8 meses de edad por múltiples exacerbaciones respiratorias, con eventos de bacteriemias asociadas a catéter venoso central y desnutrición crónica de difícil manejo cuya curva de crecimiento se observa en la figura 1. A los 6 meses de vida presenta hiperglicemias persistentes que en el contexto de patología de base, asociado a esteatocrito ácido y básico elevados permiten diagnosticar insuficiencia pancreática y se inicia suplementación de enzimas. Las glicemias capilares (GC) presentan valores variables (entre 57 a 377 mg/dl) con hemoglobina glicosilada normal de 5,7%, sin cuerpos cetónicos en orina, por lo cual se decide no iniciar terapia con insulina. Paciente no asiste a controles hasta los 2 años y 1 mes en donde se constata hiperglicemia de ayuna (142 mg/dl). Se hospitaliza y objetiva GC post prandial mayor a 300 mg/dl, orina completa con glucosuria +++, sin cuerpos cetónicos, glicemia de ayuna en 266 mg/dl, iniciándose terapia con insulina. Evolucionó con aspergilosis broncopulmonar alérgica, presenta colonización por PA y Staphylococcus Aureus (SA). Ha mantenido con adecuada función pulmonar, pero con regukar control metabóico, con mala adherencia al tratamiento. Requiere altas dosis de insulina basal y bajas dosis de insulina ultrarápida.
Caso 2
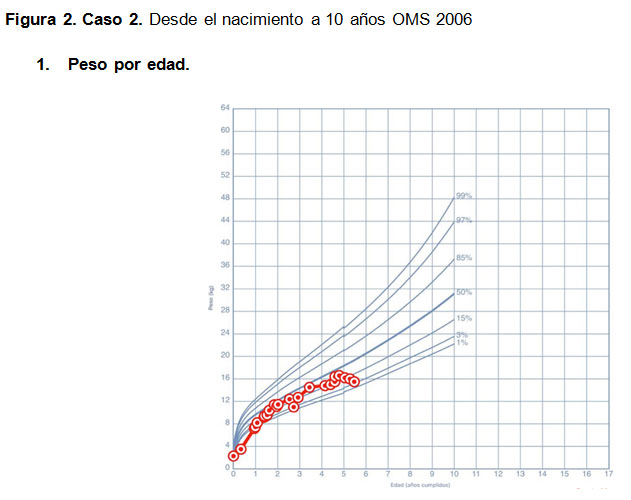
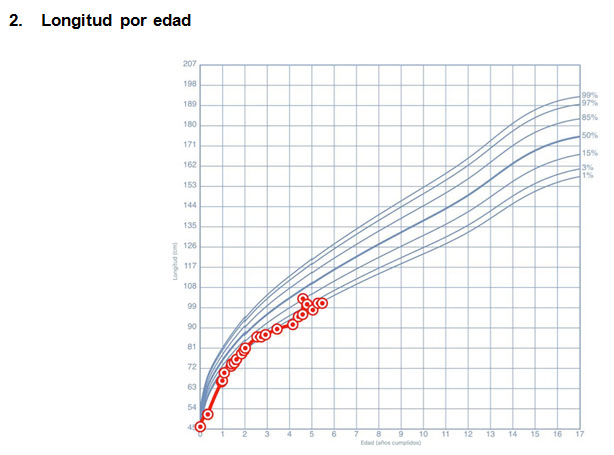
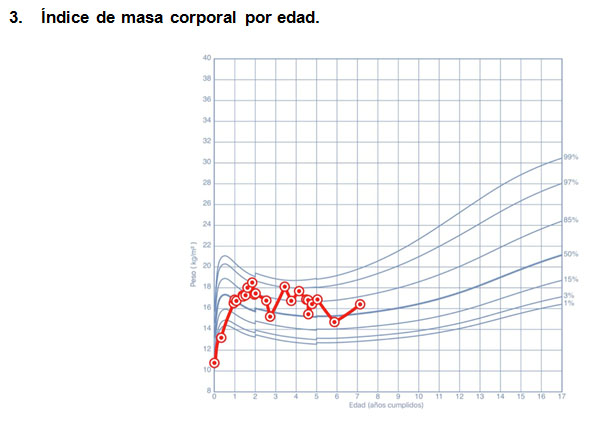
Paciente de sexo masculino de 16 años, nace de 38 semanas y peso de 2280 gramos (PEG severo). A los 2 meses de edad se hospitaliza por mal incremento ponderal, anemia severa y bronquiolitis. Madre refiere diuresis abundante, evidenciandose hiperglicemia y glucosuria. Desde esa fecha ha presentado múltiples hospitalizaciones por descompensación respiratoria, la mayoría secundaria a infección por SA. Al cumplir 7 meses presenta un test del sudor con cloro 128mEq/l, esteatocrito ácido y clásico alterados, estudio genético p.Phe508del/- y desnutrición crónica diagnosticándose una FQ con insuficiencia pancreática (Figura. 2), iniciándose suplementación con enzimas pancreáticas. A los 5 años 7 meses de edad se hospitaliza en regulares condiciones generales por descompensación respiratoria, muy decaído y enflaquecido. Ingresa con glicemia en ayuna 236 mg/dl. En ese contexto inicia terapia con insulina. Presenta además una hepatitis crónica por virus hepatitis B. Evoluciona con daño hepático crónico e hipertensión portal, hiperamonemia multifactorial, diabetes de difícil control metabólico e infección crónica por SA. Presentó aspergilosis angioinvasiva por Aspergillus Fumigatus con tomografía computada de tórax compatible. Su función pulmonar ha presentado deterioro progresivo.
Caso 3
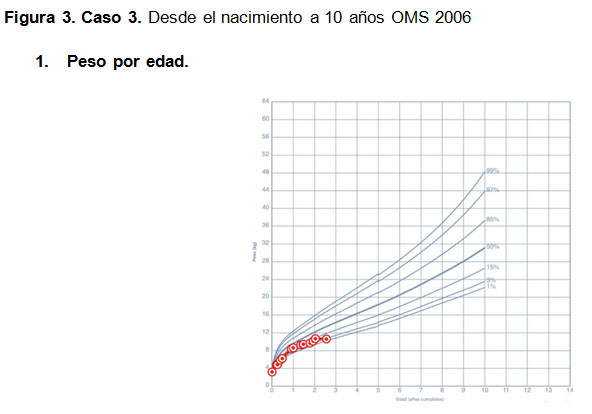
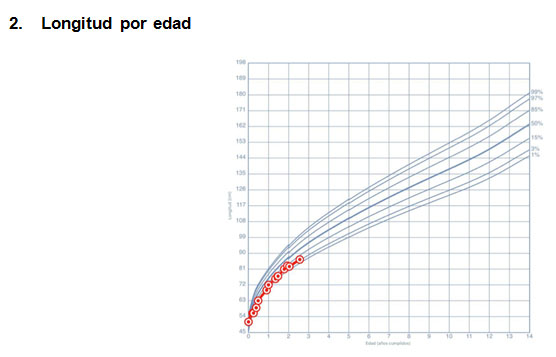
Paciente de sexo masculino de 13 años, nace de 40 semanas y peso de 3184 gramos. Hermano menor del caso 2. Desde los 15 días de vida presenta esteatorrea y tos persistente, radiografía de tórax alterada, esteatocrito ácido y clásico elevados, Test de Sudán ++, hipoalbuminemia por lo que se sospecha FQ con insuficiencia pancreática. Se inicia suplementación con enzimas pancreáticas. Se confirma el diagnóstico a los 5 meses de vida mediante un test del sudor con cloro de 61 mEq/l y estudio genético p.Phe508del/-. Evoluciona con desnutrición crónica y con múltiples hospitalizaciones por descompensación respiratoria, la mayoría secundaria a Staphylococcus Aureus. (Figura 3) Al cumplir 2 años 7 meses consulta por aumento de la ingesta de líquidos y aumento de la diuresis de 3 meses de evolución, se hospitaliza con una glicemia en ayuna de 368 mg/dl y cetosis ++, iniciándose terapia con insulina. Ha presentado regular control metabólico con mayor tendencia a hiperglicemias durante el día y algunos eventos de hipoglicemia post prandiales. Es portador de Staphylococcus Aureus, ha presentado infecciones por Pseudomona Aeruginosa y ha mantenido una adecuada función pulmonar.
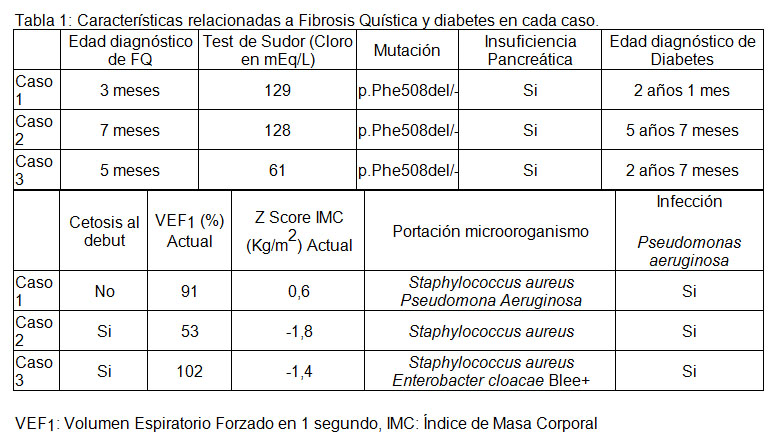
En la tabla 1 se resumen las características relacionadas a FQ y diabetes en cada caso.
Discusión
En este reporte se describen 3 casos de diabetes de inicio precoz en la vida, antes de los 6 años, en pacientes portadores de FQ atendidos en un policlínico multiprofesional en un hospital Roberto del Río en Santiago de Chile. El interés de describir estos casos radica en la precocidad del debut de diabetes en un rango etario escasamente reportado en la literatura8. Las prevalencias descritas de DRFQ es del 2% en menores de 10 años, comparado con el 6% encontrado en nuestro centro.17,18 Publicaciones de DRFQ en menores de 10 años describen que aunque es una patología infrecuente, hasta un tercio de los pacientes ya tendrá́
intolerancia a la glucosa a esa edad6,7,19. El Registro de la Fundación de Fibrosis Quística de Estados Unidos y Canadá́, que recopila información de aproximadamente 28.000 pacientes emitió́ en su Informe Anual de Datos del 2012 que 19.7% de todos los pacientes presentaron DRFQ, y su distribución según el rango etario fue del 2% en menores de 10 años, 19% en adolescentes, 40% a los 20 años y entre 45 y 50% a los 30 años.7,12,20 La DRFQ se caracteriza por una insulinopenia progresiva de inicio precoz producto de múltiples factores, entre ellos, una alteración en la despolarización de la célula beta y disfunción en la liberación de insulina producto de una falla en la conductancia de cloruro. En la célula alfa existe un aumento en la hiperpolarización y como consecuencia una supresión de glucagón21. Por otra parte la disfunción de CFTR dificulta el tráfico de vesículas producto de la reducción del contenido de agua y aumento de la viscosidad de las secreciones del contenido luminal que conduce a la obstrucción y destrucción progresiva de acinos con formación de quistes y fibrosis, reduciendo la liberación de insulina después de una despolarización5,21,22. Existe además un estado proinflamatorio por aumento de factores como interleuquina 6 que se asocia a una disminución cuantitativa y disfunción de la célula beta presente al nacimiento o en primeros meses de vida de acuerdo con estudios en modelos
animales5. Se ha descrito que esta insulinopenia asociada a la alteración del glucagón y otras hormonas pancreáticas retrasa la expresión clínica de DRFQ y hace que episodios de cetoacidosis sean infrecuentes en esta condición1. También se ha demostrado que los pacientes con FQ tienen una actividad del péptido similar al glucagón tipo 1 disminuido en comparación con los controles normales, lo que puede contribuir a anomalías de la glucosa23. La absorción de glucosa a nivel del intestino delgado es más rápida y exacerba la disminución de glucosa postprandial secundaria a una disminución en la liberación de insulina en la primera fase que es dependiente de la despolarización. La siguiente fase, independiente de la despolarización se encuentra conservada, lo que explica el estado de hiperglicemia postprandial intermitente presente en la primera fase y con tendencia a la normalización en la segunda fase de secreción de insulina. De esta manera, la DRFQ se desarrolla por un mecanismo fisiopatológico diferente a otros tipos de diabetes, y en consecuencia presenta un enfoque diagnóstico específico, ya que la hiperglicemia postprandial intermitente podría ser detectada de manera más precisa por monitoreo continuo de glucosa o antes de los 120 minutos de una carga de glucosa oral, a diferencia de la diabetes tipo 1 o 2 que se detectan con glicemias en ayuna o a los 120 minutos de una carga de glucosa oral. Debido a que la DRFQ y la Diabetes tipo 1 generalmente se superponen por la edad de diagnóstico, es importante recordar que los pacientes con FQ también pueden desarrollar diabetes tipo 19. La Diabetes tipo 1 no está́ específicamente asociada a FQ y ha sido reportada como segunda patología en estos casos por lo que se debe sospechar en pacientes con DRFQ a edad temprana8. Es importante destacar que las alteraciones en el metabolismo de la glucosa en pacientes con FQ aumentan categóricamente la morbimortalidad6,8,9. Se describe que los trastornos del metabolismo de la glucosa producen un deterioro de la función pulmonar. En DRFQ existe una acidificación del líquido de superficie de la vía aérea secundario a una alteración en la concentración de bicarbonato, la hiperglicemia además favorece la glucólisis aeróbica y aumenta la producción de lactato intracelular. Este medio ácido y viscoso favorece el desarrollo de PA; por otro lado la acidez provoca un deterioro de la actividad de péptidos antimicrobianos y su efecto microbicida en modelos animales con FQ e infecciones pulmonares24. La DRFQ se asocia a parámetros antropométricos deficientes, a una mayor frecuencia de exacerbaciones pulmonares, y por lo tanto a un aumento de la mortalidad tres veces mayor en comparación con los pacientes con FQ sin diabetes7,15,25. Es importante realizar una sospecha precoz de DRFQ, y podría ser beneficioso a futuro realizar un estudio dirigido al tipo de diabetes, estudio genético personal y familiar, estudio de patologías autoinmunes concomitantes que no han sido realizados en los casos descritos. Podría ser interesante el uso de monitoreo continuo de glucosa como método de tamizaje de la hiperglicemia postprandial transitoria característica en estos pacientes. El conocer todos los factores que participan en el desarrollo de diabetes en preescolares con FQ permitiría realizar una detección precoz y optimizar el tratamiento de la patología con el propósito de disminuir la morbimortalidad y mejorar la calidad de vida de estos niños.
Referencias
- Cano Megías M, González Albarrán O. Diabetes en la fibrosis quística: Una entidad diferente. Endocrinol y Nutr. 2015;62(1):38-44.
- BoudreauV,ReynaudQ,DuboisCL,CoriatiA,DesjardinsK,DurieuI,etal. Screening for Cystic Fibrosis-Related Diabetes: Matching Pathophysiology and Addressing Current Challenges. Can J Diabetes. 2016;40(5):466-470.
- Lek N, Acerini CL. Cystic fibrosis related diabetes mellitus - Diagnostic and management challenges. Curr Diabetes Rev. 2010;6(1):9-16.
- Salcedo Posadas A, Gartner S, Girón Moreno RM, García Novo MD. Tratado de Fibrosis Quística. España: Justim SL; 2012.
- Kayni K, Mohammed R, Mohiaddin H. Cystic Fibrosis-Related diabetes. Front. Endocrinol. 2018; 9:20.
- Alexander S, Alshafi K, Anderson AK, Balfour-Lynn I, Bentley S, Buchdahl R, et al. Clinical Guidelines: Care of Children with Cystic Fibrosis. Royal Brompt Hosp (7th Ed 2017 www.rbht.nhs.uk/childrencf (cited 07 Febr 2017). 2017.
- Brennan AL, Beynon J. Clinical Updates in Cystic Fibrosis – Related Diabetes. 2015;1(212):236-250.
- Moheet A, Moran A. CF-related diabetes: Containing the metabolic miscreant of cystic fibrosis. Pediatr Pulmonol. 2017;52(April):S37-S43.
- Jones GC, Sainsbury CAR. A Practical Approach to Glucose Abnormalities in Cystic Fibrosis. Diabetes Ther. 2016;7(4):611-620.
- Prado Carro AM, Suárez Ortega L, Cardona Hernández R, Ramon Krauel M. Alteraciones hidrocarbonadas en pacientes pediátricos con fibrosis quística. Rev Esp Endocrinol Pediatr Orig Rev Esp Endocrinol Pediatr. 2014;1(5):36-40.
- Moran A, Dunitz J, Nathan B, Saeed A, Holme B, Thomas W. Cystic Fibrosis – Related Diabetes : Current Trends in Prevalence , Incidence , and Mortality. Database. 2009;32(9):0-5.
- O’Riordan S, Dattani M, Hindmarsh P. Cystic fibrosis-related diabetes in childhood. Horm Res Paediatr. 2010;73(1):15-24.
- Larson Ode K, Frohnert B, Laguna T, Phillips J, Holme B, Regelmann W, et al. Oral glucose tolerance testing in children with cystic fibrosis. Pediatr Diabetes. 2010;3(1):1-19.
- Kim R. Cystic Fibrosis–Related Diabetes in Children: An Update. Pediatr Ann. 2016;45(9):e321-e326.
- Moran A, Brunzell C, Cohen R, Katz M, Marshall B, Onady G, et al. Clinical care guidelines for cystic fibrosis-related diabetes: A position statement of the American Diabetes Association and a clinical practice guideline of the Cystic Fibrosis Foundation, endorsed by the Pediatric Endocrine Society. Diabetes Care. 2010;33(12):2697-2708.
- Ministerio de Salud. Unidad de Salud Respiratoria. Programa Nacional de Fibrosis Quística. Orientaciones técnicas programáticas para diagnóstico y tratamiento. Chile: 2013.
- Casas L, Berry D, Logan K, Copeland K, Royall J. Cystic fibrosis related diabetes in an extremely young patient. J Cyst Fibros. 2007;6(3):247-249.
- Barrio R. Management of endocrine disease: Cystic fibrosis-related diabetes: Novel pathogenic insights opening new therapeutic avenues. EurJ Endocrinol. 2015;172(4):R131-R141.
- Sheikh S, Kelly A. Cystic fibrosis-related diabetes : links , challenges , and future directions. Res Reports Endocr Disord. 2015:157-167.
- Szypowska A, Pańkowska E. Cystic fibrosis-related diabetes. New Med.2003;6(1):8-11.
- Castellani C, Assael B. Cystic fibrosis: a clinical view. Cell Mol Life Sci. 2017;74(1):129-140.
- Kelly A, Moran A. Update on cystic fibrosis-related diabetes. J Cyst Fibros. 2013;12(4):318-331.
- Hillman M, Eriksson L, Mared L, Helgesson K, Landin-Olsson M. Reduced levels of active GLP-1 in patients with cystic fibrosis with and without diabetes mellitus. J Cyst Fibros. 2012;11(2):144-149.
- Garnett JP, Kalsi K, Sobotta M, Bearham J, Carr G, Powell J, et al. Cientific Reports 2016; 6:37-55.
- Hameed S, Jaffé A, Verge C. Cystic Fibrosis Related Diabetes (CFRD)-The End Stage of Progressive Insulin Deficiency. Pediatr Pulmonol. 2011;46(8):747-760.
|

